化学与生产、生活联系密切,下列说法正确的是
| A.常用作净水剂的KAl(SO4)2和漂白粉都是强电解质 |
| B.氯气溶于水生成的次氯酸具有强氧化性,可以起到除去水中杂质和杀菌消毒作用 |
| C.氮氧化物可以破坏臭氧层,也能形成酸雨 |
| D.“玉兔”月球车太阳能电池板可将光能转换为电能,所用转换材料是二氧化硅 |
下列事实可以用勒夏特列原理解释的是
| A.新制的氯水在光照条件下颜色变浅 |
| B.使用催化剂,提高合成氨的产率 |
| C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| D.H2、I2、HI平衡混合气体加压后颜色变深 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体②H2O③NH4Cl固体④CH3COONa固体⑤NaNO3固体⑥KCl溶液
| A.②④⑥ | B.①② | C.②③⑤ | D.②④⑤⑥ |
在给定的条件下,下列各离子组能大量共 存的是
存的是
| A.滴加酚酞试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- |
| B.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ |
| C.PH=12的溶液 K+、ClO-、NO3-、H+ |
| D.pH=1的溶液 Cu2+、Na+、Mg2+、Cl- |
常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是
①二氧化硫②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液
| A.①④ | B.①② | C.②③ | D.③④ |
已知:①lmolH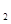 分子中化学键断裂时需要吸收436 kJ的能量②1 mol C1
分子中化学键断裂时需要吸收436 kJ的能量②1 mol C1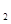 分子中化学键断裂时需要吸收243 kJ的能量③由H原子和C1原子形成l mol HCl分子时释放431 kJ的能量下列叙述中正确的是
分子中化学键断裂时需要吸收243 kJ的能量③由H原子和C1原子形成l mol HCl分子时释放431 kJ的能量下列叙述中正确的是
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是: H2(g)+Cl2(g)=2HCl(g)  |
B.氢气和氯气反应生成2 mol氯化氢气体,反应的 |
C.氢气和氯气反应生成2mol氯化氢气体,反应的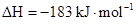 |
D.氢气和氯气反应生成1 mol氯化氢气气体,反应的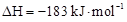 |