(共10分)向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________;如果是多种成分,可能是__________________________ 。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200mL之前,无气体产生,写出OA段发生反应的离子方程式_______________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________ (溶液体积的变化忽略不计)。
(11分)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:回答下列问题:
| 元素编号 |
元素特征信息 |
| A |
其单质是密度最小的物质 |
| B |
阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C |
其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D |
其氢氧化物和氧化物都有两性,与C同周期 |
| E |
与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C________,E________;
(2)写出A、B、C形成的化合物M的电子式________;
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________;
(4)D单质与M的水溶液反应的离子方程式:________
下表是元素周期表的一部分,回答下列有关问题: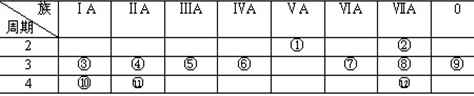
(1)写出下列元素符号:①,⑥,⑦, 11 。
(2)在这些元素中,最活泼的金属元素是,最活泼的非金属元素是,最不活泼的元素是。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是,碱性最强的是,呈两性的氢氧化物是,
(4)在这些元素中,原子半径最小的是,原子半径最大的是。
(共12分)如图转化关系中A—H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)
(1)写出下列反应的化学方程式:
A与B ____________________________________________________
Cu与H ___________________________________________________
F与甲____________________________________________________
(2)写出丙与D溶液反应的离子方程式 _______________________________________
(3)常温时H的浓溶液与丙物质并不能看到明显的反应现象,原因是_____________
。
铝是一种重要的金属,在生产、生活中具有许多重要的用途,右图是从铝土矿中制备铝的工艺流程:
已知:铝土矿的主要成分是Al2O3,此外还含有少量Fe2O3等杂质。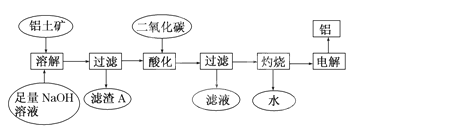
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中铝土矿主要成分发生反应的离子方程式,滤渣A的主要成分为。
(2)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是____
__________,通入过量的二氧化碳时,生成沉淀的离子方程式为_______。
(3)电解氧化铝,每生成1molAl时,生成g氧气。
(共8分)A、B、C、D、E、F六种物质的相互转化关系如下图所示,其中反应①是置换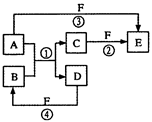 反应。
反应。
(1)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行。写出②的离子方程式:_____________________________
(2)若A为金属单质,D为非金属单质,且所含元素的原子序数A是D的2倍,原子核外最外层电子数D是A的2倍,③④反应中都有红棕色气体生成,②③④反应中的部分产物已略去。写出①的化学方程式:____写出④的化学方程式:____ __;在②③④反应中F既表现氧化性又表现酸性的是(填序号)__ ______。