某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下: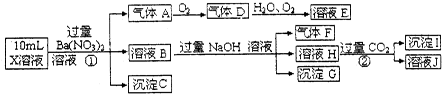
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还一定含有的离子是___________________,有一种阳离子不能确定其是否存在,若要用实验证明该离子一定不存在,其最合理的化学方法是________________。
(2)写出下列反应的离子方程式:
①中生成气体A:___________________。②生成沉淀I:______________________。
(3)假设测定A、F、I均为0.01mol,10mLX溶液中n(H+)=0.04mol,且不能确定含有的离子只有一种。当X溶液中不能确定的离子是_______时,沉淀C物质的量_______。
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下: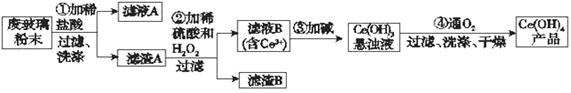
(1)洗涤滤渣A的目的是为了除去____________(填离子符号),检验该离子是否洗净的方法是_________________________________________________________。
(2)第②步反应的离子方程式是______________________________________,滤渣B的主要成分是___________________。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP______________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有_______________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为___________(结果保留两位有效数字)。
炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉(Cd)是一个有益的尝试,其流程如下:
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7。试回答下列问题:
(1)浸出时用到的试剂X为, 写出溶解过程中加快浸出速率和提高浸出率的两点措施:_______________________________,______________________________。
(2)写出加入Ca(ClO)2反应的离子方程式。
(3)调节pH过程可以选用(填“ZnO”或“NaOH”);本流程的pH调节一般调至5,其目的是。
(4)写出过滤后加入过量的锌粉反应的离子方程式。
(5)在蒸发浓缩操作时,要采取实验措施是:。
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g)△H 1 =" +489.0" kJ·mol-1
C(石墨) +CO2(g) = 2CO(g)△H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式
CO2(g) +3H2(g) CH3OH(g) +H2O(g)△H
CH3OH(g) +H2O(g)△H
①该反应的平衡常数表达式为K=。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图A所示,则该反应的ΔH0(填“>”、“<”或“=”)。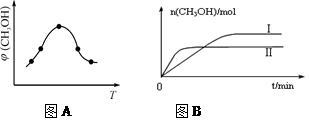
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图B所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠKⅡ(填“>” 或“<”)。
(3)以CO2为原料还可以合成多种物质。①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为。当氨碳比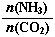 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为。
( 16分)Heck反应是合成C-C键的有效方法之一,如反应①: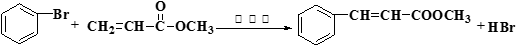
IⅡⅢ
化合物Ⅱ可由以下合成路线获得:
(1) 化合物Ⅲ的分子式为________,1 mol化合物Ⅲ完全燃烧最少需要消耗______mol O2。
(2)化合物IV分子结构中不含甲基,写出化合物IV的结构简式:______________,并写出由化合物IV反应生成化合物V的化学方程式___________________________。
(3)有关化合物Ⅱ说法正确的是_______________。
| A.1 mol 化合物Ⅱ最多可与2 mol H2发生加成反应 |
| B.化合物Ⅱ能使酸性高锰酸钾溶液褪色 |
| C.化合物Ⅱ难溶于水 |
D.化合物Ⅱ分子间聚合,反应生成的高聚物结构为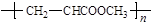 |
(4) 化合物Ⅲ的一种同分异构体VI,苯环上的一氯取代物只有一种,VI能发生银镜反应,其核磁共振氢谱共有三组峰,峰面积之比为1:2:2,VI的结构简式为_____________。
(5)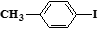 和
和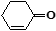 也可以发生类似反应①的反应,有机产物的结构简式_______________,①的反应类型为_____________。
也可以发生类似反应①的反应,有机产物的结构简式_______________,①的反应类型为_____________。
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.7 |
9.6 |
| 完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
| Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是_________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:______________________________________。
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称___________,洗涤所得Li2CO3沉淀要使用______________ (选填“热水”或“冷水”),你选择的理由是________________。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是:__________________________。