(1)钠镁铝三种元素中第一电离能最大的是 (填元素名称)。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
| A.NH4Cl晶体 |
| B.Na3AlF6晶体 |
| C.Na2CO3•10H2O晶体 |
| D.CSOu4溶液 |
E.CH3COOH溶液
(4)部分共价键键能数据如下表:
| 键 |
H-H |
N-H |
N-N |
N=N |
N≡N |
| 键能/kJ•mol-1 |
436 |
391 |
159 |
418 |
945 |
根据上表数据推算并写出氨气分解为氮气和氢气的热化学方程式: 。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| |
分子式 |
结构简式 |
熔点 |
沸点 |
水溶性 |
| 乙醇 |
C2H6O |
C2H5OH |
-114.3℃ |
78.4 °C |
互溶 |
| 二甲醚 |
C2H6O |
CH3OCH3 |
-138.5℃ |
-24.9℃ |
微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
(7)石墨烯的应用为电子行业的发展带来了重大的突破,其结构可以看作是单层的石墨,其中碳原子的杂化方式为 ;C60的晶体结构类似于干冰,则每个C60晶胞的质量为 (用含NA的式子表示)。
现有:①铁锅②鸡蛋③白酒④乙烯。根据所学知识,请你在上述四种物质中选择合适的物质填入下列空格中(填编号)。
(1)可以作为水果催熟剂的是 ;(2)含有乙醇的是 ;
(3)在潮湿的空气中会生锈的是 ;(4)富含蛋白质的是 。
由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,A是地壳中含量最多的金属元素。请回答: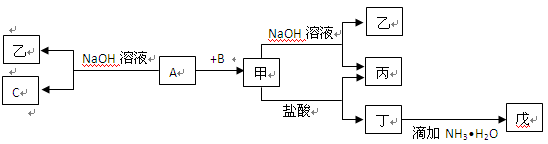
(1)写出下列物质的化学式:乙、丁、戊。
(2)写出甲物质在工业上的一种主要用途:。
(3)写出甲→乙+丙反应的离子方程式:;
A→乙+C反应的化学方程式:
下图是用自来水制取少量蒸馏水的简易装置,其原理与教材中的实验完全相同。回答下列问题:
(1)左边圆底烧瓶中要加入几片碎瓷片,其作用是;
(2)该装置中使用的玻璃导管较长,其作用是;
(3) 烧杯中还要盛有的物质是 ,其作用是:。
Na2O2可用在潜水艇里作为氧气的一种来源,供人们呼吸所需。Na2O2所发生反应的化学方程为 。在这个反应中,电子转移的总数为 被氧化的是 价态 元素,氧化剂是 。
如下图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
(1)B中X 的转化率α(X)B为。
(2)A中W和B中Z的物质的量的比较:n(W)An(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为升(用a表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是。