标准状况下,VLHCl气体溶解在amL水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为cmol/L,下列表达正确的是
| A.溶质的质量分数ω=365V/224aρ*100% |
| B.溶质的物质的量浓度c=1000V/22.4a |
| C.溶液的密度ρ=36.5c/1000ω |
| D.取题中所述溶液10mL,再加入等体积水后,所得溶液的质量分数等于0.5ω |
如图表示反应2 SO2(g)+ O2(g) 2 SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
2 SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是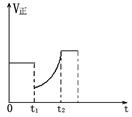
| A.t1时减小了SO2的浓度,增加了SO3的浓度,平衡向逆反应方向移动 |
B.t1时降低了温度,平衡向正 反应方向移动 反应方向移动 |
| C.t1时减小了压强,平衡向逆反应方向移动 |
| D.t1时增加了SO2和O2的浓度,平衡向正反应方向移动 |
下列叙述正确的是
| A.根据Ksp(PbI2)>Ksp(AgCl)可以得出PbI2在水中的溶解能力比AgCl大 |
| B.常温下,同浓度的Na2CO3与NaHCO3溶液相比,NaHCO3溶液的pH大 |
| C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大 |
| D.常温下pH=7的氨水与硫酸铵的混合液中c(NH4+)与c(SO42-)之比小于2 |
下列离子方程式正确的是
A.NaHS溶于水:NaHS Na++HS- Na++HS- |
| B.Na2HPO4溶于水:Na2HPO4 = 2Na++H++PO43- |
| C.熔融的NaHSO4:NaHSO4 = Na++H++SO42- |
D.HCO3-+H2O  H3O++CO32- H3O++CO32- |
下列说法中正确的是
| A.NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
B.常温下,反应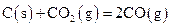 为熵增反应,可以自发进行 为熵增反应,可以自发进行 |
C.熵增加且放热的反应一定是自发反 应 应 |
| D.非自发反应在任何条件下都不能实现 |
在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,各投入0.65 g锌粒,则下图所示比较符合客观事实的是