(1)已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s) △H1 = -1206.8 kJ/mol
②Ca(s)+1/2O2(g)=CaO(s) △H2= -635.1 kJ/mol
③C(s,石墨)+O2(g)=CO2(g) △H3 = -393.5 kJ/mol
试求: ④CaCO3(s)=CaO(s)+CO2(g) △H=________。
(2)已知下列各反应的焓变
①CO(g)+1/2O2(g)=CO2(g) ΔH1= -283.0 kJ/mol
②H2(g)+1/2O2(g)=H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l)+ 3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ/mol
试求: ④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l) ΔH=________。
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
____________。
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。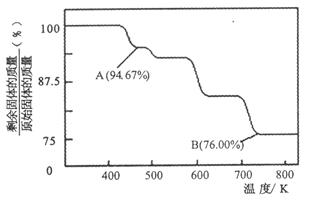
①A 点时剩余固体的成分是_________(填化学式)。
②从开始加热到 750K 时总反应方程式为_______________________。
(3)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为mol·L-1。
随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)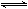 N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol·L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
0.100 |
0 |
0 |
| 10 |
0.058 |
0.021 |
0.021 |
| 20 |
0.040 |
0.030 |
0.030 |
| 30 |
0.040 |
0.030 |
0.030 |
| 40 |
0.032 |
0.034 |
0.017 |
| 50 |
0.032 |
0.034 |
0.017 |
①T1℃时,该反应的平衡常数K=(保留两位小数)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H0(填“>”、“ =”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ·mol-1
③H2O(g)=H2O(l)△H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式。
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为。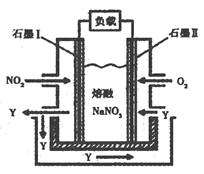
(16分)止咳酮(F)具有止咳、祛痰作用。其生产合成路线如下: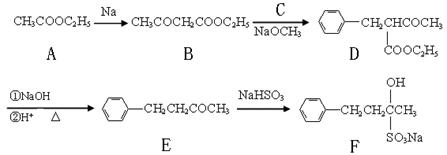
(1)写出B中含有的官能团名称:。
(2)已知B→D反应属于取代反应,写出C(C属于氯代烃)的结构简式:。
(3)写出E→F的反应类型:。
(4)满足下列条件的E的同分异构体有种。
①苯环上有两个邻位取代基;②能与FeCl3溶液发生显色反应;
③除苯环外不含其它的环状结构。
(5)写出A→B的反应方程式:。
(6)A→F六种物质中含有手性碳原子的是:(填物质代号)。
(7)目前我国用粮食发酵生产丙酮(CH3COCH3)占较大比重。利用题给相关信息,以淀粉为原料,合成丙酮。合成过程中无机试剂任选。
提示:合成路线流程图示例如下:
(15分)用煤化工产品C8H10合成高分子材料I的路线如下:
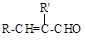 已知:(1)B、C、D都能发生银镜反应,且苯环上的一卤代物有两种。H含有三个六元环。
已知:(1)B、C、D都能发生银镜反应,且苯环上的一卤代物有两种。H含有三个六元环。
(2)RCHO+R'CH2CHO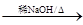 + H2O
+ H2O
根据题意完成下列填空:
(1)A的名称是; D中含有官能团的名称。
(2)D→E的反应类型是;
(3)C和H的结构简式分别为、。
(4)E→F的化学方程式是。
(5)G→I的化学方程式是。
(6)符合下列条件的G的同分异构体有种,
写出其中任意一种的结构简式
A、能发生银镜反应和水解反应,且1mol该同分异构体能消耗2mol的NaOH
B、含有苯环,但不能与FeCl3显色。
C、不含甲基
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
(1)某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了。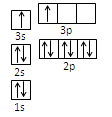
(2)ACl2分子中A的杂化类型为。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式,该物质的K原子和C60分子的个数比为。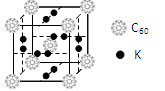
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是,NCl3分子的VSEPR模型为。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。