(8分)0.5 mol CH4中含有 ______ 个甲烷分子,________________个C原子,____________个 H原子,在标准状况下的体积为 。(用NA表示)
( 7分)有六种烃:A甲烷 B苯 C环己烷 D 甲苯 E 乙烯。分别 取一定量的这些烃完全燃烧后,生成m摩CO2和n摩水,依下述条件,填入相应烃的序号:
取一定量的这些烃完全燃烧后,生成m摩CO2和n摩水,依下述条件,填入相应烃的序号:
(1)当m=n时,烃是____;(2)当m=2n时,烃是___;(3)当2m=n时,烃是____;
(4)能使酸性高锰酸钾溶液褪色的是______;(5)能使溴水褪色但不反应的是______;
某一无色透明溶液A,焰色反应呈黄色。当向溶液中通入二氧化碳时则得到浑浊液B,B加热到70℃左右,浑浊液变澄清。向B的稀溶液中加入适量的饱和溴水,立即有白色沉淀C产生。回答下列问题:
(1)分别写出A、B、C的结构简式:
A:____________,B__________________, C:____________。
(2)完成有关反应的化学方程式:
。
乙酸苯甲酯可提高花或水果的芳香气味,常用于化妆品工业和食品工业。下图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件略去)。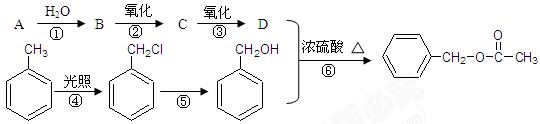
请回答:
(1)运用逆合成分析法推断,C的结构简式为。
(2)写出A→B的化学方程式为
(3)与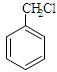 互为同分异构体的芳香族化合物有种,其中一种同分
互为同分异构体的芳香族化合物有种,其中一种同分
异构体的核磁共振氢谱有三种类型氢原子的吸收峰,该同分异构体的结构简式为 。
。
苹果酸是一种常见的有机酸,其结构简式为:.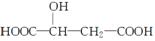
(1)苹果酸分子所含官能团的名称是______、________。
(2)苹果酸不可能发生的反应有________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应④氧化反应 ⑤消去反应 ⑥取代反应
(3)物质A(C4H5O4Br)在一定条件下可发生水解反应,得到苹果酸和溴化氢。由A制取
苹果酸的化学方程式是________________________ _。
(8分)在下列物质中:①苯 ②乙醇 ③乙酸 ④乙酸乙酯。(用序号填空)
(1)在加热有铜作催化剂的条件下,被氧化后的产物能发生银镜反应的是;
该催化氧化反应的化学方程式为。
(2)在浓硫酸和加热条件下,能发生酯化反应是 ;
;
(3 )既能发生加成
)既能发生加成 反应又能发生取
反应又能发生取 代反应的是;
代反应的是;
(4)在无机酸或碱作用下,能发生水解反应的是;
写出其在NaOH存在下水解的化学方程式。