已知某反应在不同条件下的反应历程可以表示成下图,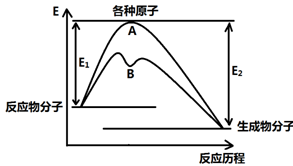
E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:
(1)据图判断该反应是 (填“吸”或“放”)热反应,如该反应可逆,则其达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”),其中B历程表明此反应改变的条件为 (填字母)。
| A.增大反应物的浓度 | B.降低温度 | C.增大压强 | D.使用催化剂 |
(2)下表给出了一些化学键的键能:
| 化学键 |
H—H |
Cl—Cl |
O=O |
O—H |
H—Cl |
| 键能(kJ·mol-1) |
436 |
247 |
x |
463 |
431 |
①若图中表示反应H2(g) +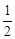 O2(g)=H2O(g) ΔH=" -" 241.8 kJ·mol-1,则x= kJ·mol-1(保留一位小数)。
O2(g)=H2O(g) ΔH=" -" 241.8 kJ·mol-1,则x= kJ·mol-1(保留一位小数)。
②催化剂、加热条件下可用氧气与氯化氢气体反应置换出氯气,同时生成另一种气态化合物,利用上表数据写出该热化学方程式 ,当该反应中有1 mol电子发生转移时,图像中历程A的E1= kJ(保留一位小数)。
据报导,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS—Na(对氨基水杨酸钠)也是其中一种。它与雷米封可同时服用,可以产生协同作用。已知:
①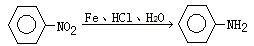 (苯胺,弱碱性、易氧化)
(苯胺,弱碱性、易氧化)
②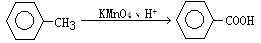
下面是PAS—Na的一种合成路线(部分反应的条件未注明):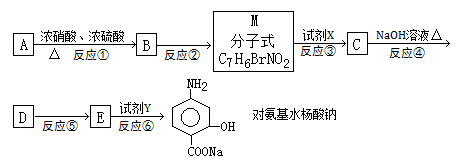
(1)A与浓硝酸和浓硫酸的混合物可以发生取代反应,在30℃时反应主要得到B和它的一种同分异构体,在一定条件下也可以反应生成TNT,请写出A制取TNT的化学方程式:,TNT的系统命名法为。
(2)写出反应②的化学方程式,注明反应条件并配平:。
(3)本题中的中间产物M的官能团的名称为,与题中M具有相同官能团的同分异构体并属于芳香族化合物的共有种(不含M本身)(不考虑立体异构)。
(4)反应①的反应类型为。
(5)试剂X为,试剂Y为。
关于金属的冶炼和应用,有以下一些问题,请按要求回答问题。
(1)工业制备铝一般是通过铝土矿制得纯净的Al2O3,然后电解Al2O3/Na3AlF6得到铝。也可用电解NaCl—KCl—AlCl3共熔体方法制铝,且比电解Al2O3/Na3AlF6制铝节省电能约30%,但现在仍用前一种方法制铝,其原因可能是()(填序号)
A.AlCl3是共价化合物,其熔融体不导电
B.电解AlCl3生成的Cl2会污染大气
C.自然界不存在富含AlCl3的矿石,故此方法所用流程较繁琐
D.生产无水AlCl3较困难,此方法总成本比另一种方法高
(2)把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为()(填序号)
A.1∶2∶3B.3∶2∶1C.6∶3∶1D.6∶3∶2
(3)航母螺旋桨主要用铜合金制造。为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合下图的信息推断该合金中除铜外一定含有(填化学式)。
(4)1.92 g铜和一定量的浓硝酸反应,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当Cu全部反应时,共收集到标准状况下气体1.12 L(无N2O4),则反应中消耗HNO3的物质的量是。
松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中18是为区分两个羟基而人为加上去的)经下列反应制得:
(1)A的分子式为__________________。
(2)γ松油醇的结构简式为_________________。
(3)α松油醇能发生的反应类型是________________(填代号)。
a.加成反应
b.水解反应
c.氧化反应
d.消去反应
e.取代反应
(4)在许多香料中松油醇还有少量以酯的形式出现,写出CH3COOH和α松油醇反应的化学方程式____________________________________________________。
(1)写出下列各物质的名称,填入括号内。
CH4 → CH3Cl → CH3OH → HCHO → HCOOH → HCOOC2H5
(甲烷)→()→(甲醇)→()→()→()
(2)某有机物的结构简式如图:
①当其和________________反应时,可转化为 。
。
②当其和________________反应时,可转化为  。
。
③当和________________反应时,可转化为 。
。
④欲将 转化为
转化为 ,则应加入__________________。
,则应加入__________________。
[选考—有机化学基础]
药用有机物A药用有机物A为一种无色液体,从A出发可发生如下一系列反应:
请回答:
(1)E中官能团的名称是___________;反应③的反应类型为.
(2)化合物F结构简式:.
(3)有机物A的同分异体甚多,其中属于酯类的化合物,且含有苯环结构的异构体有种.
(4)E的一种同分异构体H,已知H可以和金属钠反应放出氢气,且在一定条件下可发生银镜反应,试写出H的结构简式:______________________________________.
(5)写出反应①的化学方程式:______________________________________.