A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。请回答下列问题:
(1)X的化学式为______
(2)元素的非金属性C______E(填“>”、“<”或“=”),下列各项中,能说明这一结论的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。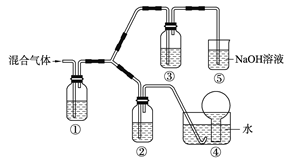
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ)NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2 NaBC2+NaBC + H2O
NaBC2+NaBC + H2O
NaOH溶液与BC气体不反应
a.装置①、②、③中盛放的药品依次是______、______、______。
b.通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
c.能够说明实验已成功的现象是___________________________。
推断题科学家们在探索生命奥妙过程中,认识到生命细胞的组成和元素周期律有密切的关系,约占人体质量99.97%的11种大量元素全部位于周期表前20号元素,其余的是十多种人体不可缺少的微量元素。现有a~g 7种短周期元素,是氧、硫、钾、钙外的其它大量元素,它们在元素周期表中的位置如下,并据此回答下列问题:
| a |
|||||||
| d |
e |
||||||
| b |
c |
f |
g |
(1)元素的原子间最容易形成离子键的是下列中的(填选项),元素的原子间最容易形成共价键的是下列中的(填选项)。
A、c和f B、b和g C、d和gD、b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是(填选项)
A、ea3 B、ag C、fg3 D、dg4
某酸是一种常见的有机酸,其结构为:
(1)此有机酸含有的官能团名称是____________;在一定条件下,此有机酸可发生化学反应的类型有 ________(填序号);
| A.水解反应 |
| B.取代反应 |
| C.加成反应 |
| D.消去反应 |
E.加聚反应
F.中和反应
(2)下列物质与此酸互为同分异构体的是_____________(填序号);




(3)写出此有机酸与足量的金属钠发生反应的化学方程式:__________________________;
下表是有机物A、B的有关信息。
| A |
B |
| ①能使溴的四氯化碳溶液退色 ②比例模型为:  ③能与水在一定条件下反应生成醇 |
①由C、H两种元素组成 ②球棍模型为: 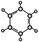 |
根据表中信息回答下列问题:
(1)A的名称为___________,A在一定条件下生成高分子化合物的反应方程式________________。
(2)A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=时,这类有机物开始出现同分异构体。
(3)B具有的性质是(填序号)。
①无色无味液体、②有毒、③不溶于水、④密度比水大、
⑤与酸性KMnO4溶液和溴水反应使之退色、⑥任何条件下不与氢气反应。
(4)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:_____________________________。
完成下列有机化合物之间的转换
(1)CH3CH=CH2 + () CH3CHClCH2Cl
CH3CHClCH2Cl
(2) ()
()
(3)CH3CH2-Br CH2=CH2
CH2=CH2
(4)()+ Br2 CH3-CBr=CHBr
CH3-CBr=CHBr
(5)
 ()(一卤代物)
()(一卤代物)
焦硫酸(H2SO4•SO3)溶于水,其中SO3都转化为硫酸。若将445 g焦硫酸溶于水配成4.00 L硫酸,该硫酸的物质的量浓度为_______________mol/L。