(16分)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下: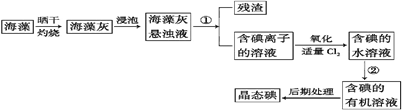
(1)指出提取碘的过程中有关的实验操作名称:① ,② 。
(2)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示)。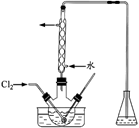
实验控制在较低温度下进行的原因是 ;锥形瓶里发生反应的离子方程式为
(3)在第②步操作过程中,可加入的有关试剂是 。
| A.酒精 | B.四氯化碳 | C.醋酸 | D.苯 |
(4)含碘离子的溶液也可以采用下图方法得到碘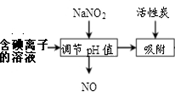
①加入NaNO2并调节pH<4,反应的离子方程式 __________________。
②流程中生成的NO尾气有毒,工业上将其与O2按一定比例通入NaOH制备NaNO2,
写出反应的化学方程式: ____________________。
(5)要测量含碘离子的溶液中I-的浓度,取25 mL该溶液,先加几滴KSCN溶液,再逐滴滴入0.1 mol·L-1FeCl3溶液, 若消耗FeCl3溶液20.4 mL,则含碘离子的溶液中I-的浓度为 。(保留两位有效数字)
(14分)四氯化锡是无色液体,熔点-33"C,沸点114℃。氯气与金属锡在加热时反应可以用来制备SnCl4 , SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过下图装置制备少量SnCl4 (夹持装置略)。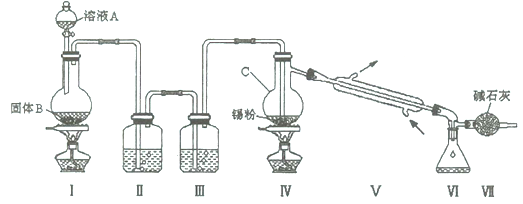
(1)仪器C的名称为;
(2)装置Ⅰ中发生反应的离子方程式为;
(3)装置Ⅱ中的最佳试剂为,装置Ⅶ的作用为;
(4)若装置连接顺序为Ⅰ—Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4 外,还会生成的含锡的化合物的化学式为。
(5)Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为;
(6)若Ⅳ中用去锡粉11.9 g,反应后,Ⅵ中锥形瓶里收集到23.8 g SnCl4 ,则SnCl4 的产率为。
(14分)某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 的硫酸溶液进行中和热的测定。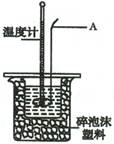 Ⅰ.配制0.50mol·L- 1硫酸溶液
Ⅰ.配制0.50mol·L- 1硫酸溶液
(1)若配制250 mL硫酸溶液,则须用量筒量取密度为1.84 g·cm- 3、质量分数为98%的浓硫酸mL。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如右图所示:
(2)仪器A的名称为;
(3)装置中碎泡沫塑料的作用是;
(4)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol- 1);
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的温度差平均值为℃;
②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c=" 4.18" J·(g·℃)- 1 。则中和热△H=(取小数点后一位)。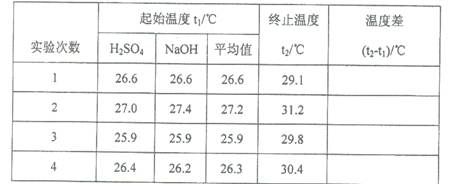
③上述实验数值结果与57.3 kJ·mol- 1有偏差,产生此实验偏差的原因可能是(填字母)。
| A.实验装置保温、隔热效果差 |
| B.量取NaOH溶液的体积时仰视读数 |
| C.一次性把NaOH溶液倒入盛有硫酸的小烧杯中 |
| D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。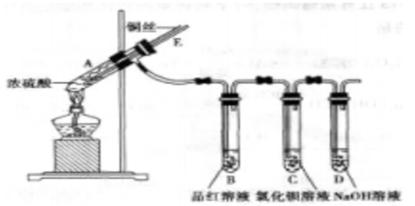
实验步骤:
①先连接好装置,检查气密性,再加入试剂;
②加热A试管,B中品红溶液褪色,熄灭酒精灯;
③将铜丝向上抽动离开液面。
(1)试管中发生反应的化学方程式为_____________________________.
(2)能够证明铜与浓硫酸反应生成气体的现象_________________________.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其分成两份,分别滴加下列溶液,将产生沉淀的化学式填入下表相应的位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
__________ |
______________ |
写出其中SO2显示还原性的反应的离子方程式___________________.
(4)实验完毕后,先熄灭酒精灯,由于导管E存在,B中的液体不会倒吸入A中,其原因是___________________________________________.
(5)实验完毕后,装置中残留气体有毒,不能打开胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是_______________________.
溴苯是一种常用的化工原料。实验室制备溴苯的实验步骤如下:
步骤1:在a中加入15 mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中,充分反应。
步骤2:向a中加入10 mL水,然后过滤除去未反应的铁屑。
步骤3:滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL 水洗涤,分液得粗溴苯。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。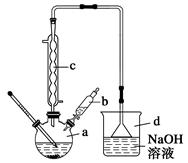
| 苯 |
溴 |
溴苯 |
|
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 在水中的溶解度 |
微溶 |
微溶 |
微溶 |
(1)仪器d的作用是。
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是。
(3)仪器c的作用是冷凝回流,回流的主要物质有(填化学式)。
(4)步骤4得到的粗产品中还含有杂质苯。已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是。
(实验班做)已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案;甲方案探究甲烷与氧化剂反应(如图1所示);乙方案探究甲烷与氯气反应的条件(如图2所示)。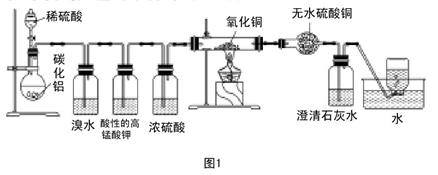
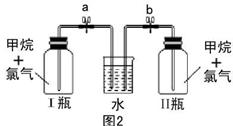
甲实验现象:溴水无颜色变化,澄清石灰水变浑浊,无水硫酸铜变蓝色。乙实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)混合气体(I、II),II瓶用预先准备好的黑色纸套套上,I瓶放在光亮处(不要放在日光直射的地方,以免引起爆炸)。按图2安装好装置,并加紧弹簧夹a和b。
(1)写出碳化铝与硫酸反应的化学方程式。
(2)实验甲中浓硫酸的作用是,集气瓶中收集到的气体能否直接排入空气中?(填“能”或“否”)。
(3)下列对实验甲有关现象与结论的叙述都正确的是()
| A.酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应 |
| B.硬质试管里黑色粉末无颜色变化,结论是甲烷不与氧化铜反应 |
| C.硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳 |
| D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应 |
(4)写出硬质试管里可能发生的化学方程式,(按甲烷与氧化铜物质的量之比4:7)
(5)过一段时间,打开图2的a、b弹簧夹,I、II中观察到现象是。