黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为:8CuFeS2+21O2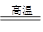 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I—氧化为I2:S2O82—+2I—=2SO42—+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程: 、 (不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
如何利用核磁共振氢谱法检测出乙醇和甲醚?
有A、B、C、D、E五种溶液,它们均不含相同的阴、阳离子。已知其阴、阳离子的范围是:Ag+、Na+、Ba2+、Al3+、Fe3+、Cl-、 、OH-、
、OH-、 、
、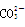 。
。
现进行如下实验:
①C溶液中加入纯铁粉,溶液的质量增加。
②A、E溶液都为碱性,测得浓度均为0.1 mol/L的A、E溶液的pH,A溶液的pH小于E。
③在B溶液中逐滴加入氨水,开始出现沉淀,继续加氨水,沉淀消失。
④在D溶液中加入Ba(NO3)2溶液,无明显变化。
(1)由上述现象可推知各溶液中所含阴、阳离子为:
| 溶液 |
A |
B |
C |
D |
E |
| 阳离子 |
|||||
| 阴离子 |
(2)写出实验①和③中反应的离子方程式。
A、B、C、D、E均为可溶于水的固体,组成它们的离子有:
| 阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 |
OH- Cl- 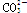 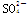 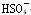 |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减小,但不消失。
据此推断它们是:
A____________;B____________;C____________; D____________;E____________。
有A、B、C、D、E、F、G 7瓶不同物质的溶液,它们分别是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如下表所示。表中“↓”表示生成沉淀或微溶化合物,“—”表示观察不到明显变化。试回答下列问题。
| A |
B |
C |
D |
E |
F |
G |
|
| A |
— |
— |
— |
— |
— |
— |
↓ |
| B |
— |
— |
— |
— |
↓ |
↓ |
↓ |
| C |
— |
— |
— |
↓ |
— |
↓ |
↓ |
| D |
— |
— |
↓ |
— |
↓ |
↓ |
↓ |
| E |
— |
↓ |
— |
↓ |
— |
↓ |
— |
| F |
— |
↓ |
↓ |
↓ |
↓ |
— |
↓ |
| G |
↓ |
↓ |
↓ |
↓ |
— |
↓ |
— |
(1)A的化学式是________,G的化学式是________,判断理由是
___________________________________________________。
(2)写出其余几种物质的化学式:B:________,C:________,D:________,E:________,F:________。
有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠。现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。
请填写下列空白:
(1)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管,观察到的现象是________________________________________________________________________
________________________________________________________________________。
被检出的物质的化学式(分子式)是________。
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式是
________________________________________________________________________
________________________________________________________________________。
被检出的物质的化学式(分子式)是________。
(3)鉴别余下未检出物质的方法和观察到的现象是
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。