(16+2分)目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中CO2的含量及有效地开发利用CO2,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒(杂质),这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为Mn2+,请写出对应的化学方程式并配平: ;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
①实验2条件下的H2O 体积分数为 ;
②下列方法中可以证明上述已达平衡状态的是 ;
a.单位时间内生成n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CO2的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
| 气化反应式 |
lgK |
||
| 700K |
900K |
1200K |
|
| C(s)+H2O(g)=CO(g)+H2(g) |
-2.64 |
-0.39 |
1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) |
-1.67 |
-0.03 |
1.44 |
则反应CO(g)+H2O(g) CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)= _。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)= _。
(3)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式 。
(4)25℃时,在20 mL0.1 mol/L醋酸中加入V mL0.1 mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,
下列说法正确的是________。
A.pH=3的CH3COOH溶液和pH=11的CH3COONa溶液中,由水电离出的c(OH—)相等
B.①点时pH=6,此时溶液中,c(CH3COO—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(CH3COO—)=c(Na+)
D.③点时V=20mL,此时溶液中c(CH3COO—)< c(Na+)=0.1mol/L
(5)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题: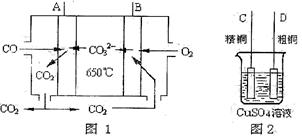
①写出A极发生的电极反应式 ;
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
下图是某医院输液用的一瓶葡萄糖注射液标签的部分内容。据此回答以下问题(答案保留2位小数):
(1)该葡萄糖溶液的物质的量浓度为______mol·L-1。
(2)已知葡萄糖在人体组织中发生缓慢氧化,提供生命活动所需要的能量:
C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H=-2804kJ·mol-1则该瓶葡萄糖注射液大约可为病人提供______kJ的热量。
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。结合有关知识,回答下列问题: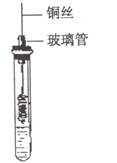
(1)乙醇分子中的官能团是。
(2)在试管里加入2mL乙醇。把一端弯成螺旋状的铜丝放在酒精外焰中加热,使铜丝表面生成一薄层黑色的氧化铜,立即把它插入盛有乙醇的试管里(如右图),取出铜丝,可以观察到铜丝表面。
(3)乙醇汽油作为一种新型车用燃料,符合我国的能源战略,推广使用乙醇汽油的好处是(写出一条即可)。
A、B、C、D四种元素都位于短周期内,它们的原子序数依次递增, A原子核内仅含有一个质子,B原子的电子总数与D原子最外层电子数相等, A原子与B原子的最外层电子数之和与C原子最外层电子数相等,D原子有2个电子层,最外层电子数是次外层电子数的3倍,且D只能形成阴离子。由此回答:
(1)四种元素的元素符号为:A_________B_________C__________D____________,C在元素周期表的位置。
(2)由A、D两种元素形成的二种化合物的化学式为____________和______________
写出下列有关的化学方程式。
⑴4g CH4在氧气中燃烧生成CO2和液态水,放出222.5kJ热量。写出CH4燃烧的热化学方程式。
⑵乙醇催化氧化成乙醛的化学方程式。
⑶苯与溴发生取代反应的化学方程式。
以短周期元素回答下列有关问题(稀有气体元素除外)(填相应的元素符号或物质的化学式)
⑴金属性最强的元素是,非金属性最强的元素是。
⑵原子半径最大的是,适合作半导体的是。
⑶其最高价氧化物的水化物具有两性的物质是,该物质与金属性最强的元素的最高价氧化物的水化物发生的化学方程式是。