(本题共12分)下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。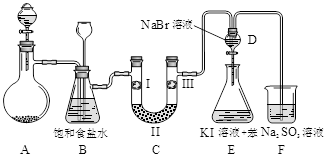
32.制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为: 。
33.装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 。
34.装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 。
| |
A |
B |
C |
D |
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
35.设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为深棕红色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 。该现象 说明溴的非金属性强于碘(填“能”或“不能”),原因是 .
用密度为1.84g/cm3,质量分数为98%的浓硫酸配制100mL 1.00mol/L 的稀硫酸。
(1)在容量瓶的使用方法中,下列操作不正确的是____________
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处, 用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(2) 经计算,上述浓硫酸的浓度为_______ mol/L。配制100mL1.00mol/L的稀硫酸,应用量筒量取浓硫酸的体积为_______mL(保留一位小数),量取时应选用_______ (填序号①10mL、②50mL 、③100mL)规格的量筒。
(3)请将下列步骤补充完整:
a.量取所需浓硫酸在烧杯中加适量蒸馏水溶解,待溶液冷却到室温后将其沿玻璃棒移入mL的容量瓶中,并将洗涤液移入容量瓶中。
b.向容量瓶内加水,直到液面接近刻度线cm时,改用小心地加水至溶液凹液面与刻度线相切。
c.将容量瓶盖好瓶盖,摇匀。
⑷配制过程中如果出现下列情况,会使溶液物质的量浓度如何变化?(填“偏高”、“偏低”或“不变”)
转移时未洗涤烧杯,则结果;
所用容量瓶未干燥,则结果;
定容时俯视,则结果。
某金属氯化物MCl227g,含有0.40molCl-,则该氯化物的物质的量为______,摩尔质量为,金属M的相对原子质量为。
除去括号内的杂质,写出所加试剂的化学式⑴Cl-(SO42-):⑵SO42-(CO32-):⑶ Fe2+(Cu2+):
用于分离或提纯物质的方法有:A 蒸馏(分馏) B.萃取C.过滤D.重结晶E.分液。下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)淀粉液中含有泥沙(2)分离四氯化碳与水的混合物
(3)分离汽油和煤油(4)分离碘水中的碘单质
(5)KNO3晶体中含有少量食盐。
(8分)下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。請根据此表,结合学过的化学知识,回答下列问题:
| 配料表 |
精制海盐、碘酸钾(KIO3) |
| 含碘量 |
20―40mg/kg |
| 储藏方法 |
密封避光、防潮 |
| 食用方法 |
烹调时待食品熟后加入碘盐 |
据物质分类中的树状分类法有关知识,在① HIO3② 碘酸钠 ③ KOH ④ I2O5 ⑤ NaCl五种均属于(填“混合物”或“化合物”或“盐”或“氧化物”),其中与碘酸钾(KIO3)属于同类物质的有 _________(填序号)。
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)溶于水(填“能”或“不能”),化学性质:碘酸钾(KIO3)在受热时。