某金属氯化物MCl2 27g,含有0.40molCl-,则该氯化物的物质的量为______,摩尔质量为 ,金属M的相对原子质量为 。
贝诺酯为一种新型非甾体类抗风湿、解热镇痛抗炎药,可以通过以下方法合成: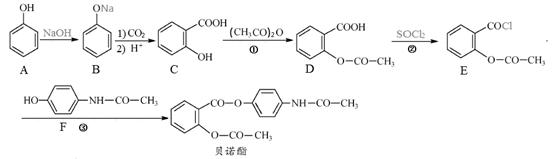
已知:
①
②RCOCl与 和
和 均反应,两者共存时后者更易于反应
均反应,两者共存时后者更易于反应
请回答下列问题:
(1)D的含氧官能团为 和 (填名称)。
(2)反应①生成产物D和X,则产物X的结构简式为 。
(3)在上述三步反应中,属于取代反应的是 (填序号)。
(4)D的一种同分异构体满足下列条件:Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。Ⅱ.分子中有4种不同化学环境的氢,且分子中含有苯环。
写出该同分异构体的结构简式: 。
(5)根据已有知识并结合相关信息,写出以 和乙醇为原料制备有机物F的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
和乙醇为原料制备有机物F的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: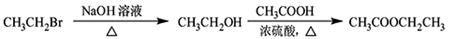
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下: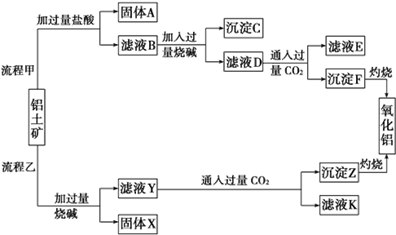
请回答下列问题:
(1)流程乙加入烧碱后生成SiO32-的离子方程式为_____________________________。
(2)验证滤液B含Fe3+,可取少量滤液并加入_______________________(填试剂名称)。
(3)滤液E、K中溶质的主要成分是_______________________(填化学式)。
(4)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________________。
(5)工业上通过电解氧化铝和冰晶石的熔融液来冶炼金属铝。已知电极材料为惰性材料,阳极反应式为______________________。
(6)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X.已知每转移3mol e-,有1.5mol化合物X生成,此反应的化学方程式_________________________。
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 化学方程式 |
焓变△H/kJ·mol-1 |
|
| 甲烷氧化 |
CH4(g)+2O2(g)=CO2(g)+2H2O(g) |
△H1=-802.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) |
△H2=-322.0 |
|
| 蒸气重整 |
CH4(g)+H2O (g)=CO(g)+3H2(g) |
△H3=+206.2 |
| CH4(g)+2H2O (g)=CO2(g)+4H2(g) |
△H4=+165.0 |
(1)已知反应CO(g)+H2O(g)=CO2(g)+H2(g) △H=_______________ kJ·mol-1。
(2)反应CO(g)+H2O(g) H2(g)+CO2(g)化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一:
H2(g)+CO2(g)化学平衡常数表达式为K= ;反应的平衡常数随温度的变化如表一:
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
从上表可以推断:此反应是_______________ (填“吸”、“放”)热反应。
(3)在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mo1,则达到平衡后CO的转化率为_____。
(4)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g) ΔH。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图。
CH3OH(g) ΔH。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图。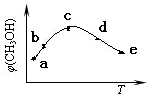
对图进行分析,从a到c段曲线变化特点看,温度升高甲醇体积分数增高的原因可能是:______________;将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有_______。
利用碳-碳偶联反应合成新物质是有机合成的研究热点之一,如: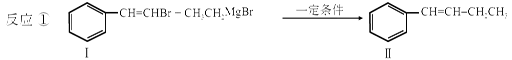
化合物Ⅰ可以由以下合成路线获得:
(1)化合物Ⅱ的分子式为__________________。1mol Ⅱ最多能与________molH2反应。
(2)化合物Ⅳ生成化合物Ⅴ的化学方程式为_____________;(注明反应条件)
化合物Ⅲ与NaOH水溶液共热的化学方程式为_____________。(注明反应条件)
(3)化合物Ⅵ是化合物Ⅲ的一种同分异构体,其苯环上只有一种取代基,Ⅵ的催化氧化产物Ⅶ能发生银镜反应。VI的结构简式为_____________,Ⅶ的结构简式为_____________。
(4)有机物  与BrMgCH2(CH2)2CH2MgBr在一定条件下按物质的量2:1发生类似反应①的反应,生成的有机化合物M(分子式为C18H22)的结构简式为____________________。
与BrMgCH2(CH2)2CH2MgBr在一定条件下按物质的量2:1发生类似反应①的反应,生成的有机化合物M(分子式为C18H22)的结构简式为____________________。
【化学-有机化学基础】(13分)某科研小组通过以下路线合成某种药物F:
已知:
①已知同一个碳原子上连有两个羟基是不稳定的,易失去水形成羰基;
②A、B核磁共振氢谱表明分子中均有4种化学环境的氢,峰面积之比分别为1:2:2:1、2:2:2:1;
③ 。
。
(1)下列关于D的说法正确的是 (填序号)。
a.属于芳香族化合物 b.既能与金属钠反应也能与氢氧化钠反应
c.属于苯酚的同系物 d.D在一定条件下也能转化为C
(2)C的分子中的官能团名称为_______________。F的结构简式为_______________。
(3)检验B分子中官能团的化学试剂为_______________________。
(4)生成A的化学方程式为__________,反应类型是__________。
(5)E有多种同分异构体,其中符合下列条件的同分异构体有_____种。
①其水溶液遇FeCl3溶液呈紫色;②属于酯类;③能发生银镜反应