Ⅰ.实验室经常要制取某种气体并验证该气体的性质。
(1)下列装置不适合用作尾气吸收的是 (填序号)。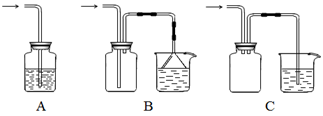
(2)向下列装置中通入气体X,A中品红溶液褪色,则X可能是SO2、Cl2等等。如果要证明X 是SO2气体,接下来的操作是:________________________________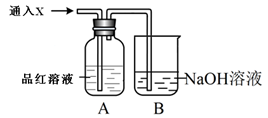
Ⅱ.实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀。有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象。请完成以下空白:
(1)取一定体积的0.1mol.L-1NaOH溶液放于烧杯中,加热煮沸后,再滴入几滴植物油;
(2)选择装置________(填“甲”或“乙”),将(1)所得溶液加入到装置中并按图示组装好装置。在你选择的装置上标明电极材料B为____________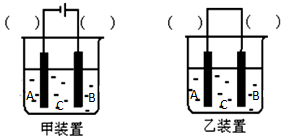
(3)实验中可在某电极处附近看到稳定的白色Fe(OH)2沉淀。若把NaOH溶液换成NaCl溶液,一段时间后则最先在 处附近(填A、B或C)看到稳定的白色沉淀。为了尽快看到稳定的白色沉淀,可以采取的措施是 (只写一种即可)
(4)如果要看到白色沉淀转化为红褐色沉淀的的现象,接下来的操作可以是__________
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请到答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是,其中发生反应的化学方程式为;
(2)实验过程中,装置B、C中发生的现象分别是、,这些现象分别说明SO2具有的性质是和;装置B中发生反应的离子方程式为;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象;
(4)尾气可采用溶液吸收。
某中学研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的性质、制法和用途,进行了如下实验:
实验一、如图Ⅰ~Ⅳ所示。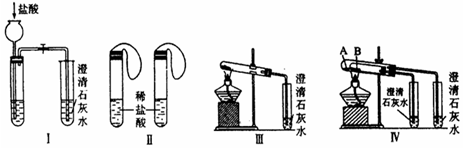
(1)若用实验Ⅳ来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是(填装置序号)。其中能够说明泡沫灭火器中选择碳酸氢钠与酸反应制CO2而不选择碳酸钠的实验是。
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,采用实验Ⅲ能否达到实验目的?(填能或不能)。若能,请说明其计算所需的数据;若不能,请简要说明理由。
实验二、将碳酸氢钠溶液与澄清石灰水混合并充分反应。
当石灰水过量时,反应的离子方程式为。
实验三、检验“侯氏制碱法”制得的纯碱中是否混有食盐和小苏打。
(1)检验纯碱中是否混有食盐的试剂是;
(2)证明纯碱中混有小苏打的实验方法是。
某研性学习小组用下图装置验证二氧化锰对氯酸钾分解的催化作用,实验时均以生成25mL气体为准,相关数据见下表:
(1)仪器组装完成后,检验该套装置气密性的操作_________________________________________.
(2)上述实验中的待测数据应是________________________________________________.
(3)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中应注意_______________________________________________________.
(4)实验小组经过讨论,认为上述实验还不能完全证明MnO2一定起了催化作用,需再补做实验。请利用实验反应后的剩余物和下面提供的合适用品补做实验(简要说明实验步骤,可不填满,也可以补充)。提供的用品有:H2O2溶液、浓盐酸、硝酸、MnO2、NaOH溶液、AgNO3溶液、KClO3、木条、淀粉-KI试纸、蒸馏水及必要的实验仪器。
①_____________________________________________________________________________
②_____________________________________________________________________________
③_____________________________________________________________________________
甲同学设计如图所示装置研究氯气能否与水发生反应。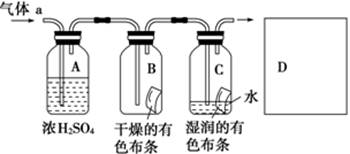
气体a的主要成分是含有少量空气和水蒸气的氯气。请回答下列问题:
(1)浓硫酸的作用是。
(2)证明氯气和水反应的实验现象为 ___________。
(3)从物质性质的方面看,这样的实验设计存在的缺陷为____________________________________,请用离子方程式表达图中D框克服事故隐患的措施_________________________________________。
实验是进行化学研究的重要手段之一。请回答下列问题:
(1)下列实验操作,正确的是____________________(填写序号)。
a.称取氢氧化钠固体时,应将氢氧化钠固体直接放在左边托盘内,右边托盘放砝码
b.用纸槽往试管里装粉末状药品时,试管应先横放再直立
c.试管、烧杯、量筒、集气瓶都不能用酒精灯直接加热
d.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在玻璃棒搅拌下慢慢加入浓硫酸
e.闻气体气味时,应取一瓶盛满气体的集气瓶,稍打开玻璃片,用手轻轻扇地在瓶口扇动,使极少量的气体飘进鼻孔,闻气味
(2)实验室需用1000mL 0.1 mol/L标准Na2CO3溶液,请回答下列问题
①在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有 _______。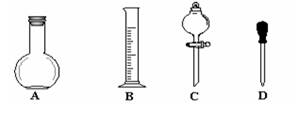
②在容量瓶的使用方法中,下列操作正确的是____________(填写序号)。
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流注入容量瓶中,然后加蒸馏水。
d.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
③配制1000 mL 0.1 mol·L-1 Na2CO3溶液的实验步骤如下:
a.计算应称取碳酸钠固体的质量为________g。
b.称量碳酸钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量的蒸馏水溶解称量好的碳酸钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
上述步骤的正确操作顺序为_______________________(用序号表示)。