电解原理在工业生产中有广泛的应用。
(1)如图为离子交换膜法电解饱和食盐水的原理示意图,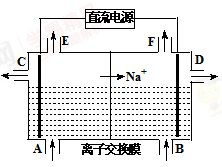
下列说法不正确的是 。
| A.直流电源的左侧为负极 |
| B.从E口逸出的气体是H2 |
| C.从B口加入含少量NaOH的水溶液以增强导电性 |
| D.从C口出来的溶液为NaOH溶液 |
E.每生成22.4 L Cl2,便产生2 mol NaOH
F.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液
G.该离子交换膜为阳离子交换膜
(2)双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为:3H2O+3O2  O3+3H2O2。则阳极的电极反应式为 ,阴极的电极反应式为 。
O3+3H2O2。则阳极的电极反应式为 ,阴极的电极反应式为 。
(3)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。工业上用如下方法制备高铁酸钾:以Fe2O3为阳极电解KOH溶液。
①高铁酸钾溶液长时间放置不稳定,会产生红色絮状物质及气泡,则该过程的离子方程式为 。
②电解制高铁酸钾时阳极的电极反应式为 。
物质的分离是化学研究中常用的方法,填写下列物质分离时需使用的方法(不必叙述操作细节)
(1)两种互不相溶的液体的分离。
(2)固体和液体的分离。
(3)含固体溶质的溶液中除去部分溶剂。
(4)胶体中分离出可溶电解质。
(5)几种沸点相差较大的互溶液体的分离。
找出物质之间的相互联系和区别,从中发现规律,这是我们学好化学的一种基本方法。下面是五种含氮元素物质的化学式:
a.N2 b.NH3 c.N2O4 d.N2O e.HNO3 请你回答:
(1)五种物质中氮元素的化合价由低到高的顺序是____(用序号表示)。
(2)仔细观察,在这五种物质中,你还可以发现其它几个规律,请你写出其中一个,并排列成序(排列顺序用序号表示):
规律:______________________________________;排序:_______________________。
用适当的化学用语填空:
(1)①一个铜原子②3个铝离子__________
③4个质子 ④铵根离子中氮元素的化合价
⑤氧化铁 ⑥硝酸银
⑦CO32-中数字“2”的含义_________________________
⑧写出一种质子数为9且电子数为10的微粒符号
(2)某粒子M2+核外有10个电子,其核内中子数为12,则M元素的相对原子质量为。
(3)一个A原子的质量为a克,一个氧原子的质量为b克,现以氧原子质量的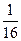 为标准,则AO2的相对分子质量为。
为标准,则AO2的相对分子质量为。
白色粉末A由Na2SO3、Na2SO4 和NaCl等物质中的二种或三种混合而成,取一定量A样品,投入100 mL 2.2 mol·L-1 盐酸中,充分反应后过滤,最终得到100 mL含H+ 的物质的量浓度为1 mol·L-1 的滤液。若将此滤液蒸干,只得到8.19g纯净物B。
(1)B的化学式;
(2)则所取的A样品中含有的各物质的物质的量分别为;
该样品与投入的盐酸反应后生成气体的体积为(标准状况)。
实验室只有36.5%(d=1.19)的浓盐酸,现需配制100mL10%(d=1.08)的盐酸,需36.5%的浓盐酸__________mL。在配制过程中,用到的仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要____________。定容时,如果眼睛仰视刻线,配制的溶液的浓度将__________(填偏高,偏低,无影响),10%的盐酸逐滴加入到纯碱溶液中,反应的离子方程式为;