【化学—选修3物质结构与性质】(14分)
现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1。
(1)Y与W所形成化合物晶体的晶胞如图所示。在1个晶胞中,W离子的数目为 。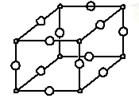
(2)在Y与X形成的分子中,Y原子轨道的杂化类型是 。
(3)X与Y形成的气态物质在X与Z形成的气态物质中有很大的溶解度,其原因是存在氢键,若在两种氢化物的混合溶液中,再滴加少量的乙醇,则分子间存在 种不同类型的氢键。
(4)Y与Z可形成化合物Y2Z。
①请写出一种与Y2Z互为等电子体的分子的化学式 。
②请预测Y2Z分子的空间构型为 。
(5)Y与Z元素相比,基态原子的第一电离能谁大? (用元素名称回答)。
(6)X的氯化物与Y元素的气态氢化物的水溶液反应可形成配合物[W(YX3)4]Cl2,1 mol该配合物中含有σ键的数目为 个。
(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。
某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验: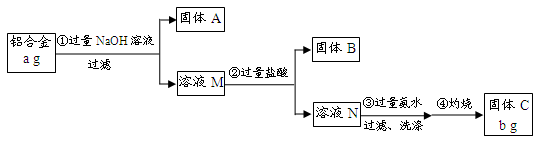
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是;
(2)生成固体B的离子方程式为;
步骤③中生成沉淀的离子方程式为;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为
;
(4)该样品中铝的质量分数是;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是;
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第③步中沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
下图表示各物质之间的转化关系。已知:常温下B、D、F、G、I、J是气体, F、G是空气中的主要成分,D是一种碱性气体。A中阴、阳离子个数比是1∶1, E是一种黑色氧化物,H是紫红色金属单质。(部分生成物和反应条件省略)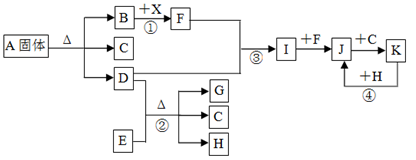
请按要求填空:
(1)A物质的化学式是;
(2)反应③的化学方程式是;
反应④的离子方程式是;
(3)反应①中产生标准状况下1.12L气体F,则转移的电子数目是;
(4)检验溶液A中阳离子的方法是
;
(5)反应②中氧化剂是;
短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P轨道中有3个未成对电子。
(1)C原子的电子排布式为,若A为非金属元素,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于键(填“σ”或“π”)。
(2)当n=2时,B位于元素周期表的第周期族,BC2属于分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于晶体。
如图所示3套实验装置,分别回答下列问题。
(1)装置1中的Cu是极(填“正”或“负”),该装置发生的总反应的离子方程式为。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为极
② 乙烧杯中电解反应的离子方程式。
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理装置3所示。
①请写出A、B两处物质的名称:A___________________B____________________
②请写出电解食盐水的离子方程式__________________________________________