氢气、纳米技术制成的金属燃料、非金属固体燃料已应用到社会生活和高科技领域。(1)已知短周期金属元素A和B,其单质单位质量的燃烧热大,可用作燃料。其原子的第一至第四电离能 如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
899.5 |
1757.1 |
14848.7 |
21006.6 |
| B |
738 |
1451 |
7733 |
10540 |
①根据上述数据分析, B在周期表中位于 区,其最高价应为 ;
②若某同学将B原子的基态外围电子排布式写成了ns1np1,违反了 原理;
③B元素的第一电离能大于Al,原因是 ;
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由
。
②C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子相对稳定结构,则C60分子中σ键与π键的数目之比为 。
(b)Ⅰ.(3分)(1)下列有关有机物的说法正确的是________;
| A.甲烷分子具有平面正方形结构 |
| B.正丁烷和异丁烷互称为同系物 |
| C.蔗糖水解反应的产物葡萄糖和果糖互为同分异构体 |
| D.苯分子中含有碳碳双键,可以和溴水发生加成反应 |
Ⅱ.(15分)乙烯是一种重要的基本化工原料,其产量是一个国家石油化工发展水平的标志。以乙烯为原料还可以合成很多的化工产品。已知乙烯能发生以下转化:
(1)乙烯的结构简式为;乙酸乙酯的分子式为。
(2)反应③的反应类型是,B物质的官能团名称为。
(3)写出以下反应的化学方程式:
②_____________________________;
③。
(4)石油经_________可以获得汽油、煤油、柴油等轻质油,还可以通过_________和_________得到乙烯、丙烯、甲烷等重要化工基本原料。
(1)小苏打是某种治疗胃酸过多的胃药的主要成分,请写出该反应的离子方程式:。
(2)在海水提溴过程中,吸收塔中用SO2和H2O将Br2转化成氢溴酸以达到富集的目的,请写出化学方程式:。
(3)(NH4)2Fe(SO4)2属于盐类,溶于水后会电离出NH4+和Fe2+,写出检验的操作和现象:
a:检验Fe2+:取少量样品于试管中,;
b:检验NH4+ :取适量样品于试管中,。
选择适当的试剂,除去以下物质中的杂质:
(1)苯中的甲苯;
(2)乙醇中的水;
(3)乙酸乙酯中的乙酸。
四苯基乙烯是一种在建筑及医疗设备、包装和电器制造中使用的化合物,结构如图。它的一氯代物有种,分子中能共面的碳原子最多有个。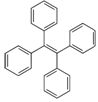
写出下列反应的化学方程式:
(1)乙烯与水反应:。
(2)把浓溴水滴入苯酚溶液中:。
(3)溴乙烷与NaOH的乙醇溶液共热:。
(4)CH2=CHCOOCH2CH3的聚合反应:。