向100mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是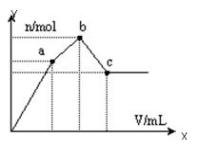
| A.c点溶液呈碱性 |
| B.b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200 mL |
| D.a点的溶液呈中性 |
用铜电极电解CuSO4溶液,下列说法正确的是
| A.溶液的酸性增强 |
| B.电极产物为铜和氧气 |
| C.阳极质量减小,阴极质量增加 |
| D.加入氧化铜可使溶液恢复到原状态 |
某有机化合物的相对分子质量为90,取一定质量的该物质完全燃烧生成二氧化碳与水的物质的量相等,无其它物质生成。下列说法正确的是
| A.该化合物肯定含O元素 | B.无法确定是否含有O元素 |
| C.该化合物中肯定含有碳碳双键 | D.该化合物的结构只有一种 |
已知某反应方程式为 ,下列说法错误的是
,下列说法错误的是
| A.反应物的分子式为C10H10O4 |
| B.X的结构简式为CH3OH |
| C.反应物和生成物具有相同的不饱和度 |
D.生成物中带“※”号的C原子来自“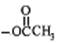 ”中的甲基 ”中的甲基 |
化合物A(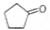 )可由环戊烷经三步反应合成:
)可由环戊烷经三步反应合成: ,则下列说法错误的是
,则下列说法错误的是
| A.反应1可用的试剂是氯气 |
| B.反应1为取代反应,反应2为消去反应 |
| C.反应3可用的试剂是氧气和铜 |
| D.1molA完全燃烧消耗6mol氧气 |
金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有良好的治愈率,已知金丝桃素的结构简式如图所示,与下列某试剂充分反应,所得有机物分子的官能团种类增加,则该试剂是
| A.Br2的CCl4溶液 | B.稀硫酸 |
| C.O2 / Cu | D.H2 |