(1)氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为 ,其沸点比液氨 (填“高”或“低”),该氢化物与足量盐酸反应的化学反应方程式为
(2)类似于碳原子,氮原子间也可形成链状结构。某链状结构氮氢化合物中,氮原子间只以N-N单键形式连接形成氢化物。该系列氮氢化合物化学通式为 (n表示氮原子个数)
(3)生活中广泛使用烃类物质(CmHn)燃料,火箭发射时的高能燃料常用氮氢化合物,比如肼N2H4。2014年10月31日在测试飞行时坠毁的维珍银河公司“太空船2号”商业载人飞船用N2H4燃料,但助燃剂选择不当据说是事故原因之一。经分析该助燃剂分子由氮、氧原子组成,分子中原子最外层电子总数和CO2分子中原子最外层电子总数相同。该助燃剂的化学式为 。上述燃烧反应产物绿色、环保,书写该燃烧反应的化学方程式为
(4)分子式为N4的氮元素同素异形体,结构等同于白磷,N4中每个原子满足最外层8e-结构。则1molN4中含有 对共用电子对。已知NH3、-NH2、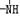 、
、 一定条件下都可以和H+结合。则N4和足量的H+反应生成的粒子的化学式为 。化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为
一定条件下都可以和H+结合。则N4和足量的H+反应生成的粒子的化学式为 。化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为
某化学反应的反应物和产物如下:
KMnO4+ KI+ H2SO4→ MnSO4 + I2 + KIO3+ K2SO4 + H2O
(1)该反应的氧化剂是。
(2)如果该反应方程式中I2和KIO3的化学计量数都是5
①KMnO4的化学计量数是。
②在下面的化学式上标出电子转移的方向和数目
KMnO4+ KI + H2SO4 →
(3)如果没有对该方程式中的某些化学计量数作限定,可能的配平化学计量数有许多组。原因是。
(10分) 容积固定的密闭容器中,发生可逆反应:M(g)+N(g)  2P(g)+Q(g) ΔH>0,
2P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N 的浓度是,P 的体积分数为_________。
(2)若反应温度升高,M的转化率____________ (填“增大”“减小”或“不变”,下同),平均相对分子质量____________,混合气体密度____________。
(12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)  CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题:
CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题: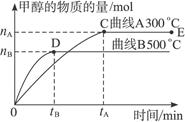
(1)反应达到平衡时,升高温度,v正_____________ (填“增大”“减小”或“不变”)。化学平衡向移动
(2)500 ℃,从反应开始到平衡,H2的反应速率v(H2)=________________________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_____________。
| A.氢气的浓度减小 | B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 | D.重新平衡时n(H2)/n(CH3OH)增大 |
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是__________________________(用化学方程式表示)。
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是_____________(填“吸热”“放热”)反应。
(2)当反应达到平衡时,升高温度,A的转化率_____________ (填“增大”“减小”或“不变”),
原因是_________________________________________________________________。
(3)反应体系中加入催化剂对反应热是否有影响并说明原因_________________________
___________________________________________。
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_____________,E2_____________ (填“增大”“减小”或“不变”)。
由金红石(TiO2)制取单质Ti,涉及的步骤为: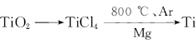
已知:①C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g) ====2CO2(g) ΔH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g) ====TiCl4(s)+O2(g) ΔH="+141" kJ·mol-1
则(1)TiO2(s)+2Cl2(g)+2C(s) ====TiCl4(s)+2CO(g)的ΔH=____________________。
(2)碳在氧气中不完全燃烧生成CO的热化学方程式为_______________________________。