碳及其化合物应用广泛。
I 工业上利用CO和水蒸汽反应制氢气,存在以下平衡:
CO(g)+H2O(g)  CO2(g)+H2(g)△H>0
CO2(g)+H2(g)△H>0
(1)向1L恒容密闭容器中注入CO(g)和H2O(g),830℃时测得部分数据如下表。则该温度下反应的平衡常数K=______________。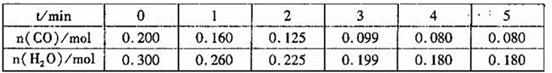
(2)相同条件下,向1L恒容密闭容器中,同时注入2mol CO、2mol H2O(g),1molCO2和1mo1H2,此时v(正 ) __________v(逆)(填“>”“=”或“<”)
(3)上述反应达到平衡时,要提高CO的转化率,可采取的措施是_______(填字母代号)。
| A.升高温度 |
| B.加入催化剂 |
| C.增大压强 |
| D.增加CO的浓度 |
E.及时分离出CO2
II 已知CO(g)+1/2 O2(g)=CO2(g) △H=一141 kJ·mol-1
2H2(g)+ O2(g)=2H2O(g) △H=一484 kJ·mol-1
CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(g) △H=一726 kJ·mol-1
(4)用CO(g)、H2(g)化合制得液态甲醇的热化学方程式为___________________________。
III某同学设计了一个甲醇燃料电池,并用该电池电解100mL一定浓度NaCl与CuSO4混合溶液,其装置如图: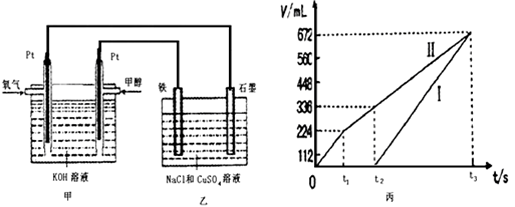
(5)写出甲中通入甲醇这一极的电极反应式__________________________________ 。
(6)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中CuSO4的物质的量浓度____________mol/L。(假设溶液体积不变)
(7)将在t2时所得的溶液稀释至200mL,该溶液的pH约为___________。
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式 。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数分别为 个、 个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子、离子化学式分别为 、 (各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图2所示。
三聚氰胺分子中氮原子轨道杂化类型是 ,1 mol三聚氰胺分子中σ键的数目为 。
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素A、B、C的第一电离能由小到大的是 (用元素符号表示)。
(2)E的最高价含氧酸中E的杂化方式为 。
(3)F原子的外围电子排布式为 。
(4)DE,GE两种晶体,都属于离子晶体,但配位数不同,其原因是 。
(5)已知DE晶体的晶胞如图所示,若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小立方体”中心各放置一个A原子,且这4个“小立方体”不相邻。位于“小立方体”中的A原子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A—A键的键长为a cm,NA表示阿伏加德罗常数的数值),则该晶胞中含有 个A原子,该晶体的密度是 g·cm-3(列式表示)。
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。
(2)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是 。
(3)Na3AsO4可作杀虫剂。As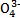 的空间构型为 ,与其互为等电子体的一种分子为 。
的空间构型为 ,与其互为等电子体的一种分子为 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的化学式为 ,As原子采取 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母)。
| A.离子键 | B.σ键 | C.π键 | D.氢键 E.配位键 F.金属键 G.极性键 |
A、B、C、D、E五种短周期元素,已知:
①原子半径递增顺序为:A、D、C、B、E
②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小
③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数的,
请回答下列问题:
(1)写出E单质在D单质中燃烧产物的电子式: 。
(2)C2A4·H2O与NH3·H2O相似,水溶液也呈弱碱性,用电离方程式表示其水溶液呈弱碱性的原因: 。
(3)B、D、E三种元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化。当a mol Y转化成a mol X时:(溶液中进行)
①若加入a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。
②若加入0.5a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。
(4)C2A4可用作高能燃料电池的燃料,生成物之一为C的单质,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极反应: ;用该电池电解过量CuSO4溶液,共收集到3.36 L(标准状况)的气体,电池消耗6.4 g C2A4,则该燃料的利用率为 。
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y |
地壳中含量最高的元素 |
| Z |
存在质量数为23,中子数为11的核素 |
| W |
生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R |
有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W在元素周期表中的位置为 ;X、Y、Z、W四种元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的结构式为 ;B的电子式为 。化合物ZY中存在的化学键类型为 。
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为 ,其最高价氧化物对应的水化物的化学式为 。该族二、三、四周期元素的气态氢化物的稳定性从大到小的顺序是 (用化学式表示)。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为 。检验溶液中R3+常用的试剂是 ,可以观察到的现象是 。
(5)Z W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。