A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
。
(3)写出A、B两元素相互反应的化学方程式:
。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
。
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的一些问题:
(1)下述反应中,H2O2仅体现氧化性的反应是(填代号)_________________。
| A.Na2O2+2HCl=2NaCl+H2O2 | B.Ag2O+H2O2=2Ag+O2↑+H2O |
| C.2H2O2=2H2O+O2↑ | D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O |
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是___________(填字母代号)。
(3)某强酸性反应体系中,反应物和生成物共六种物质或离子:O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。
①该反应中发生还原反应的过程是__________________________________。
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子数为_________。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+ H2O2+ H2O=A+NH3↑,试指出生成物A的化学式为_______________,并阐明H2O2被称为“绿色氧化剂”的理由是______________________________________________。
分现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比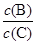 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量_________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______;而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
在2L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=____。已知:K(300℃)>K(350 ℃),则该反应正反应是___热反应。
(2)下图中表示NO2的变化的曲线是______。用O2表示从0~2 s内该反应的平均速率v(O2)=__________。
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是______。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
分物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)_________ ___________________________。
(3) 某温度时,0.01mol/L的NaOH溶液pH=11,则该温度__________25℃(填“>”、“<”或“=”)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10 mol/L,则该溶液的pH为_________。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈__________(填“酸性”、“碱性”或“中性”),溶液中c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(5)若物质的量浓度相同的CH3COOH和NaOH溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈___(填“酸性”、“碱性”或“中性”),醋酸体积____氢氧化钠溶液体积(填“>”、“<”或“=”)。
(6)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)  Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
Ag+(aq)+Cl-(aq) 在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为__________________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
分已知溶液中只存在OH-、H+、Na+、CH3COO-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质,则该溶质是___________,溶液中c(H+)_____c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为_____________,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质为_________________。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH)__________c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)__________c(H+)(填“>”,“=”或“<”)。