(10分)图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4 2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
闭合S,发现G电极附近的溶液变红,20 min后,将S断开,此时C、D两极上产生的气体体积相同;据此回答:
(1)A电极的电极材料是______________(填“PbO2”或“Pb”)。
(2)电解后,要使丙中溶液恢复到原来的浓度,需加入的物质是________(填化学式)。
(3)到20 min时,电路中通过电子的物质的量为________。
(4)0~20 min,H电极上发生反应的电极反应式为______________
中学化学中几种常见物质的转化关系如下: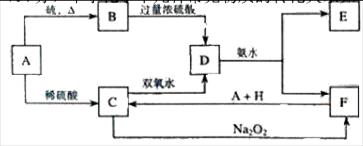
将 D滴入氢氧化钠溶液中可得到F的红褐色沉淀。请回答下列问题:
(1)A、B、C、D、 E、F、H的化学式:AB __
E、F、H的化学式:AB __ _________、D ___________、E。
_________、D ___________、E。
(2)写出 C的酸性溶液与双氧水反应的离子方程:________________________。
(3)写出鉴定E中阳离子的离子方程式:。
请在横线部分写出正确的化学方程式或离子方程式(每题2分,共12分)
(1)镁在二氧化碳中燃烧。
(2)铝与碱溶液反应的离子方程式。
(3)实验室制氢氧化铝的离子方程式。
(4)铝与四氧化三铁高温反应。
(5)氢氧化亚铁在空气中变质。
(6)少量铁在氯气中燃烧 。
。
(本题共 7分)把金属铁加入含FeCl3、FeCl2、CuCl2的混合液中充分反应后,
(1)铁全部溶解,且没有固体,则滤液中肯定有的阳离子,可能有的阳离子 (2)过滤,滤出不溶物有铜,则滤液中肯定有的阳离子,肯定不存在的阳离子,可能有的阳离子
(2)过滤,滤出不溶物有铜,则滤液中肯定有的阳离子,肯定不存在的阳离子,可能有的阳离子
(3)过滤,滤出不溶物有铁,则滤液中肯定有的阳离子,肯定不存在的阳离子。
( 10分)分别除去下列各物质中的杂质,在空白处写出所用试剂的化学式
(1)除去MgCl2中混有的少量MgCO3,可选用试剂
(2)除去FeCl3溶液中混有的少量FeCl2 ,可选用试剂
,可选用试剂
(3)除去SiO2中混有的少量CaO,可选用试剂
(4)除去FeCl2溶液中混有的少量Cu2+,可选用试剂
(5 )除去Fe粉中混有的少量铝粉,可选用试剂
)除去Fe粉中混有的少量铝粉,可选用试剂
某芳香烃A有如下转化关系: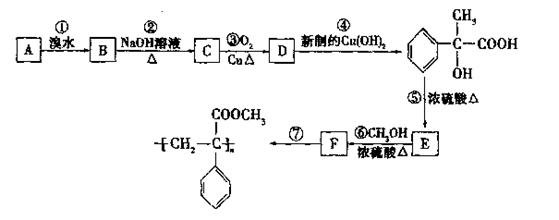
(1)反应②和⑤的类型:②属于反应;⑤属于反应。
(2)A、F的结构筒式A;F。
(3)反应③、⑥的化学方程式:
③;
⑥。
(4)D还可以和新制的银氨溶液反应,化学反应方程式为:。
(5)有机物E有多种同分异构体,请写出与E具有相同官能团的所有同分异构体(不含E):。