金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
⑴工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为 ;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为 mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
⑵铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。
计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-
(10分) (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
①丙烷脱氢可得丙烯。已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6 kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2 (g)+H2(g)的△H=kJ·mol-1。
②以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应总方程式为
;放电时CO32-移向电池的(填“正”或“负”)极。
(2) 反应A(g)+B(g)
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。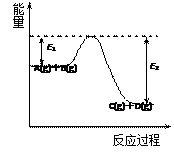
①该反应是_______________反应(填“吸热”“放热” );
②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小”“不变” );
③反应体系中加入催化剂对反应热是否有影响?_____________,原因是______________________________________________________________________。
(12分)(1)已知离子反应: +6I—+6H+=R—+3I2+3H2O,n=,R元素在
+6I—+6H+=R—+3I2+3H2O,n=,R元素在 中的化合价是。
中的化合价是。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: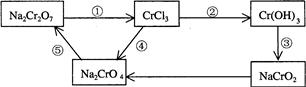
①在上述有编号的步骤中,需用氧化剂的是(填编号)。
②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
__Na2Cr2O7+__KI+__HCl——__CrCl3+_NaCl+__KCl+__I2+ (用单线桥表示电子转移的方向、数目)
(用单线桥表示电子转移的方向、数目)
当反应中有3mol电子转移时,氧化产物的质量是。
(1)请指出下列做法中分别应用了哪些分离方法?(过滤、蒸发、蒸馏 、萃取、结晶)
a、熬煮中药__________________ b、分离豆浆和豆渣__________________
c、用海水晒盐_________________ d、海水淡化__________________
(2 )今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、H+、M g2+、Ba2+、CO32-、SO42-,现取两份100mL溶液进行如下实验:
g2+、Ba2+、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加入足量NaHCO3溶液后,收集到气体0.03mol。
②第二份加足量Ba(NO3)2溶液充分反应后过滤干燥,得干燥沉淀4.66g。
根据上述实验回答:
(a )原溶液中一定不存在的离子是_______________________。
)原溶液中一定不存在的离子是_______________________。
(b)原溶液中可能存在的离子是_______________________。
(c)请计算出原溶液中一定存在的阴离子的物质的量浓度________________。
某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、NH4+、Cl-、CO32-和SO42-。现每次取100.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体0.896L(标准状况下)
②第三份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。
请回答:
(1)c(CO32-)=______。
(2)K+是否存在?;若存在,浓度范围是(若不存在,则不必回答第2问)。
(3)根据以上实验,不能判断哪种离子是否存在?若存在,这种离子如何进行检验?
(1)0.5molH2O的质量为________,其中共含有________个原子。
(2)质量都是50g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是_____(填分子式,下同),在相同温度和相同压强条件下,体积最大的是_____ 。
。
(3)在_____mL0.2mol/LNaOH溶液中含1g溶质;配制50mL0.2mol/LCuSO4溶液,需要CuSO4·5H2O________g。