已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,其中A与B形成可使红色石蕊试纸变蓝的气体,C的最高价氧化物对应水化物呈强碱性,D的离子半径是所在同周期元素简单离子半径中最小的,B与E可形成三角锥型分子且每个原子最外层都满足8电子稳定结构。
(1)B在元素周期表中的位置为第 周期 族,BA3空间构型为 ;
(2)物质甲是C在氧气中燃烧的产物,甲的电子式为 ; C、D、E各自形成的简单离子半径由小到大的顺序为 (用离子符号表示)
(3)E的同族元素的氢化物中沸点最低的是 (写分子式)
(4)物质乙由A和B元素组成,分子中含18个电子。常温常压下,3.2g液态乙在空气中燃烧生成B的单质,同时放出aKJ热量,该反应的热化学方程式为 。
(5)将10.8g D单质与15.6g甲混合后,完全溶于水中得1L溶液,所得溶液中溶质的物质的量浓度
为 (溶液体积变化忽略不计),产生的气体在标况下体积为 L。
(11分)A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示: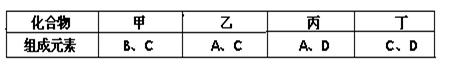
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白:
(1)丙物质的电子式为,丁物质中阴离子与阳离子的个数之比为。
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为QKJ,试写出表示甲物质燃烧热的热化学方程式。
(3)B、C两种元素按原子个数比为1:2可形成化合物戊,A、C、D三种元素按原子个数比为1:1:1可形成化合物己,则己与戊按物质的量之比为3:2完全反应后的溶液中各离子浓度的大小关系为。
(4)某同学设计了一个以结构简式是BA3-CA物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如下图: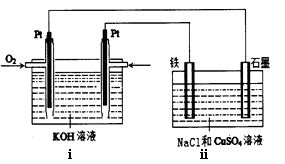
①写出ⅰ中通入该物质这一极的电极反应式。
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式;在t2时所得溶液的pH约为。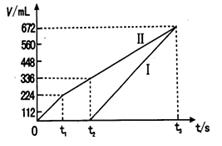
现有五种可溶性物质A,B,C,D,E,它们所含的阴、阳离子互不相同,所含离子分别为下表中所示:
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是和(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕灰色沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解。则:
①X为
| A.SO32ˉ | B.SO42ˉ | C. SiO32ˉ | D. CH3COOˉ |
②用离子方程表示B溶于水后和水的反应
③将0. 02 mol的A与0.0 1mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量
(精确到0.1g)
④利用(1)中已经确定的物质,能否检验出D,E中的阳离子?(填“能”或“不能”)
(3)将Cu投人到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有
红棕色气体出现。则物质D一定含有上述离子中的(填相应的离子符号);有关反应的离子
方程式为:
(8分) 元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体。
(1)元素周期表1-20号元素中,某两种元素的原子序数相差3,周期数相差1。
①这样的两种元素的组合有________种。
②若这样的两种元素形成的化合物中原子数之比为1∶1。
写出其中一种化合物的名称:____________________________;
(2)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示: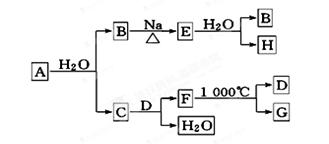
请回答下列问题:
①F的化学式为________,D的电子式为________________
②E与水反应的化学方程式为________________________________;
③实际生产中,可由F为原料制备单质A,写出制备过程的化学方程式(不需考虑综合经济效益)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最多的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E原子的核外电子排布式为,A、B、C、D的第一电离能最小的是
(2)B的氧化物的熔点远高于D的氧化物的熔点,理由是
(3)A的最高价含氧酸根离子中,其中心原子是杂化,D的低价氧化物的空间构型为
(4)A、C形成某种化合物的晶胞结构如右图所示,则其化学式为
(5)E单质的晶体的晶胞结构如下图。若E原子的半径是r cm,则E单质的密度的计算公式是(用NA表示阿伏伽德罗常数)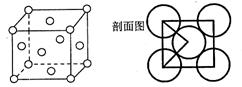
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)  2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
| 温度/℃ |
1538 |
1760 |
2404 |
| 平衡常数K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
该反应的△H0。(填“>”、“=”或“<”)
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率, 可以采取的措施是。
A.降低温度B.加催化剂
C.增加压强D.增加O2浓度
E.分离出一氧化氮
(4)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应:
N2(g)+O2(g)  2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)
(5) NO在科学界被誉为“明星分子”, 用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂。已知 火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气)。
且:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
请写出肼与NO2反应的热化学方程式_______________________________________________