“过碳酸钠”(2Na2CO3·3H2O2)俗称固体双氧水,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂和供氧剂,广泛应用于洗涤、印染和医药等领域。“过碳酸钠”的制备流程如下: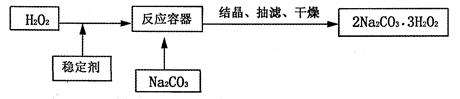
请回答下列问题:
(1)H2O2在催化或受热条件下易分解,说明化学变化的速度和 相关;
(2)在“过碳酸钠”中加入下列物质时,不会导致“过碳酸钠”变质的是 (填序号)。
| A.二氧化锰 |
B.稀盐酸 |
C.硫酸钠 |
D.石灰水 |
(3)“过碳酸钠”极易分解,得到碳酸钠、水和氧气,其反应方程式可表示为
2(2Na2CO3.3H2O2)==4Na2CO3+6H2O+3O2↑
请通过计算说明(必须有计算的过程):
①若“过碳酸钠”分解产生氧气12g,则同时产生碳酸钠的质量是多少?
②若将上述产生的碳酸钠全部配制成溶质质量分数为10.6%的溶液,共需水多少毫升?
请根据下图所示的实验过程和提供的数据,试回答下列问题: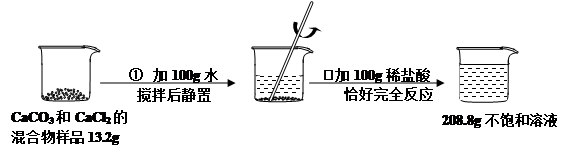
(1)在第②步实验操作中,观察到的一项实验现象是:。
(2)第①步实验操作后,烧杯中溶液里含有的溶质是(写化学式)。
(3)计算原混合物样品中CaCl2的质量(写出计算过程,结果精确至0.1g)。
刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示。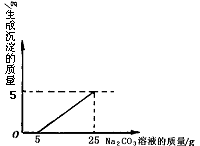
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质除含有CaCl2外,还含有______________;
(2)求Na2CO3溶液中溶质的质量分数。(计算结果精确到0.1%)
(3)求题(1)滤液中还含有溶质的质量(计算结果保留一位小数)。
某中学化学兴趣小组为探究实验室制取氧气。把干燥、纯净的氯酸钾和二氧化锰的混合物30g装入大试管中,加热。待反应完全后,将试管冷却、称量,得到20.4g固体物质。试计算:
(1)完全反应后制得氧气多少克?
(2)原混合物中氯酸钾的质量分数。(计算结果用百分数表示,保留到小数点后一位数字)
在“侯式联合制碱法”的工艺流程中,最后一步是用加热碳酸氢钠的方法来制取纯碱。某纯碱生产厂制得的产品Na2CO3中混有少量NaHCO3。为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3 Na2CO3+CO2↑+H2O, Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。
Na2CO3+CO2↑+H2O, Na2CO3受热不分解),反应过程中生成二氧化碳气体的质量与反应时间的关系如图所示。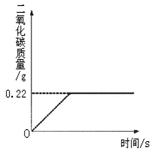
请解答下列问题:
(1)反应过程中生成二氧化碳的质量为g
(2)100g混合物中NaHCO3的质量;
黄铜是铜、锌合金,它用于制造机器、电器零件等。为测定某黄铜样品中铜的质量分数,取10g该黄铜样品,将40g19.6%的稀硫酸分四次加入,实验结果如下表:
| 19.6%r的硫酸/g |
10g |
10g |
10g |
10g |
| 生成的氢气/g |
0.04g |
0.04g |
Xg |
0. 02g |
(1)X的值是g
(2)该黄铜样品中铜的质量分数。