甲醇是一种可再生能源,具有广泛的开发和应用前景。
I.工业上合成甲醇一般采用下列反应:CO(g)+2H2(g) CH3OH(g) △H=-90.1 kJ/mol。
CH3OH(g) △H=-90.1 kJ/mol。
(1)一定条件下,向一恒温恒容的密闭容器中充入2molH2和1molCO发生反应,则能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.H2和CO的浓度比保持不变
b.容器内混合气体的平均相对分子质量保持不变
c.容器内混合气体的密度保持不变
d.2υ正(CO)= υ逆(H2)
(2)将一定量的H2和CO分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2 |
CO |
H2 |
CO |
|||
| 1 |
T1 |
2 |
1 |
0.4 |
|
5 |
| 2 |
T2 |
4 |
2 |
|
0.2 |
3 |
①实验1从开始到反应达到化学平衡时,v(CH3OH)表示的反应速率为 ,该温度下的平衡常数K= 。
②T1 T2(选填“>”、“<”或“=”)。
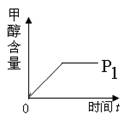
(3)下图是压强为P1时容器中甲醇含量的变化曲线,请在该图中补画出(不用计算,定性处理)该反应在P2(P2>P1)时甲醇含量的变化曲线。
Ⅱ.甲醇在一定条件下也能合成被誉为“21世纪的清洁燃料”二甲醚(DME)。
(4)工业上制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) △H 1
CH3OH(g) △H 1
②CO(g)+H2O(g) CO2(g)+H2(g) △H 2
CO2(g)+H2(g) △H 2
③3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H3
CH3OCH3(g)+CO2(g) △H3
④2CH3OH(g) CH3OCH3(g)+H2O(g) △H 4
CH3OCH3(g)+H2O(g) △H 4
则△H 4= 。
(5)二甲醚直接燃料电池具有启动快,效率高等优点,某科研小组研制出以二甲醚为燃料的新型燃料电池,电解质为熔融碳酸盐,电池总反应方程式为:CH3OCH3+3O2=2CO2+3H2O。该电池的正极通入O2和CO2,负极通入二甲醚,则负极的电极反应式为_________________。
硫酸和硝酸是中学阶段常见的两种强酸,请就两者与金属铜的反应情况回答下列问题:
(1)在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是(填写代号):
| A.7.32L | B.6.72L | C.20.16L | D.30.24L |
(2)若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式。
今有①盐酸②硫酸③醋酸三种酸:
(1)在同体积,同PH的三种酸中,分别加入足量的锌粉,在相同条件下产生H2的体积由大到小的顺序是____________
(2)在同体积、同浓度的三种酸中,分别加入足量的锌粉,在相同条件下产生H2的体积由大到小的顺序是____________
(3)物质的量浓度为0.1 mol·L—1的三种酸溶液的PH由大到小的顺序是_____________;如果取等体积的0.1 mol·L—1的三种酸溶液,用0.1 mol·L—1的NaOH溶液中和,当恰好完全反应时,消耗溶液的体积由大到小的顺序是_______________(以上均用酸的序号填写)。
设水的电离平衡线如下图所示。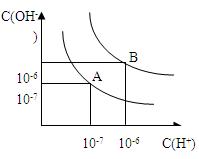
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从___________增加到____________;
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐酸的体积比为__________。
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g) CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
,升高温度,K值(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a. 氢气的浓度减少 b. 正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加 d. 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)。
短周期元素A、B、C、D位于同周期且原子序数依次增大。已知A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化 物之间两两皆能反应,均生成盐和水。请完成下列各小题:
物之间两两皆能反应,均生成盐和水。请完成下列各小题:
(1)A、B、C三种阳离子的半径由大到小的顺序是: >>(填写离子符号)
(2)指出元素D在元素周期表中的位置:__________________________。
(3)元素B的氧化物属于化合物(填“离子”或“共价”),其电子式为。
(4)A、C元素的最高价氧化物所对应的水化物之间反应的离子方程式为。
(5)含有C阳离子的盐常用来净化水,其原因为
。
(用离子方程式表示和适当的文字说明)