【化学—物质结构与性质】氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti原子的电子排布式是________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2  2NH3,实现储氢和输氢。下列说法正确的是________________。
2NH3,实现储氢和输氢。下列说法正确的是________________。
| A.NH3分子中氮原子的轨道杂化方式为sp2杂化 |
| B.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体 |
| C.相同压强时,NH3的沸点比PH3的沸点高 |
| D.[Cu(NH3)4]2+中,N原子是配位原子 |
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是___________。
(4)N2H4中的N原子的杂化类型是__________;N与O第一电离能大小关系是:N___O。
(5)NiO的晶体结构与氯化钠相同,在晶胞中镍离子的配位数是_______。已知晶胞的边长为a nm,NiO的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则NiO晶体的密度为_________g·cm-3。
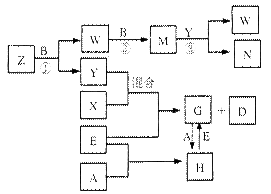 A、B、C、D、E是中学化学常见的五种单质,已知A、B、C、D在常温下均为气态,E为金属,其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
A、B、C、D、E是中学化学常见的五种单质,已知A、B、C、D在常温下均为气态,E为金属,其中D能分别跟A、B、C在一定条件下化合,生成对应的化合物X、Y、Z,其中常温下,Y为液体,X、Z为气体。有关的转化关系如下图所示(反应条件均已略去)。
(1)化合物Z的空间构型为;构成A的元素的最高价氧化物水化物的化学式为;实验室贮存N的方法是。
(2)写出反应②的化学反应方程式;G→H的离子方程式。
(3)常温下,D与A反应生成1 mol X时放热92.3kJ,写出该反应的热化学方程式:
。
(4)将过量的E加入N的稀溶液中,若反应过程中转移电子的数目为3.01×1023,则参加反应的E的质量为g。
已知:G是一种常用的药用有机物,合成路线如图所示:
①有机物A和C都能与FeCl3发生显色反应,且取代基处于邻位
②有机物G只含碳、氢、氧元素且式量小于200,氧元素的质量分数为35.56%。
请回答:
(1)写出A、C、K的结构简式A________C________K__________
(2)反应①~⑨中,属于取代反应的有______________(填序号)
(3)写出F的常见同分异构体与F在浓硫酸条件下的反应_____________________
(4)写出G在加热条件下与NaOH溶液反应的化学方程式_______________________
(5)写出反应⑥的方程式____________________。
萝卜中具有较多的胡萝卜素,它是人体的主要营养之一。α-胡萝卜素的结构为: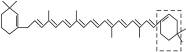
(1)写出α-胡萝卜素的分子式________。
(2)1 mol胡萝卜素最多能与________ mol Br2反应。
(3)β-胡萝卜素与α-胡萝卜素互为同分异构体,且只是虚线框内部分不同,但碳的骨架相同,写出β-胡萝卜素方框内可能的结构简式:______________________。
A、B两种烃通常状况下均为气态,它们在相同状况下的密度之比为1∶3.5。若A完全燃烧,生成CO2和H2O的物质的量之比为1∶2,则A的分子式是________,B的分子式是________。
某烃A 0.2 mol在O2中充分燃烧时,生成化合物B、C各1.2 mol。试完成下列问题:
(1)烃A的分子式为________,B、C的分子式分别是________,________。
(2)若一定量的烃A燃烧后生成B和C各3 mol,则有________g烃A参加了反应,燃烧时消耗标准状况下O2________L。
(3)若烃A不能因反应而使溴水褪色,在一定条件下能与Cl2发生取代反应,其一氯代物只有一种,则烃A的结构简式为___________。