【化学——物质结构与性质】
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节。
Ⅰ.氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是 (填序号)。
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1 mol水分子可形成4 mol氢键
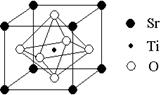
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图,则其化学式为 。
Ⅱ.氢气的存储
(3)Ti(BH4)2是一种储氢材料。
①Ti原子在基态时的核外电子排布式是 。
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为 。
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。
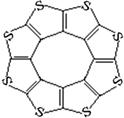
①元素电负性大小关系是:C S(填“>”、“=”或“<”)。
②分子中C原子的杂化轨道类型为 。
③有关键长数据如下:
| |
C—S |
C=S |
C16S8中碳硫键 |
| 键长/pm |
181 |
155 |
176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S与C=S之间,原因可能是: 。
④C16S8与H2微粒间的作用力是 。
Ⅰ.化学反应总是伴随能量变化,已知下列化学反应的焓变
2HI(g)=H2(g)+I2(g) △H1
SO2(g)+ I2(g) + 2H2O(g)=H2SO4(l)+2HI(g) △H2
H2SO4(l)=H2O(g) + SO2(g) +1/2O2(g) △H3
2H2O(g)=2H2(g)+ O2 (g) △H4
(1)△H4与△H1、△H2、△H3之间的关系是:△H4=。
(2)若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) 在150℃下能自发进行,则△H ____ 0
A.大于B.小于C.等于 D.大于或小于都可
Ⅱ.以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) △H=QkJ/mol (Q>0)
CH3CH2OH(g)+3H2O(g) △H=QkJ/mol (Q>0)
在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。完成下列填空:
(1)表示CH3CH2OH体积分数曲线的是____(选填序号)
(2)在一定温度下反应达到平衡的标志是_____
A.平衡常数K不再增大
B.CO2的转化率不再增大
C.混合气体的平均相对分子质量不再改变
D.反应物不再转化为生成物
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是_______(选填编号);达到平衡后,能提高H2转化率的操作是_______(选填编号)
A.降低温度B.充入更多的H2C.移去乙醇D.增大容器体积
(4)图中曲线a和c的交点R对应物质的体积分数yR=_______%
【化学—选修3物质结构与性质】(1)A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(KJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
根据上述信息,写出B的基态原子核外电子排布式,预测A和氯元素形成的简单分子空间构型为。
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为,中心离子的配位数为。
(3)参考下表中的物质熔点回答下列问题
| 物质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
| 熔点(℃) |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
根据上表数据解释钠的卤化物及碱金属的氯化物的熔点变化规律。
(4)C60可用作储氢材料。C60的结构如图1。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确,并阐述理由。科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为。
(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是,l mol三聚氰胺分子中含mol 键。
键。
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为(用含a、b、c的式子表示)。
【化学——选修2:化学与技术】(15分)利用生产磷铵[(NH4)3PO4]排放的废渣磷灰石[(Ca3(PO4)2)]制取硫酸并联产水泥的工艺流程如下:
(1)操作a的名称,实验室中进行此操作时用到的玻璃仪器有。
(2)在实验室中操作b包括____、冷却结晶。
(3)干燥机中发生反应的化学方程式为。
(4)水泥常用做建筑材料,是利用了水泥的性质。
(5)SO2的催化氧化反应为2SO2(g)十O2(g) 2SO3(g)。实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
2SO3(g)。实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
①实际生产中,SO2的催化氧化反应是在常压、400℃—500℃条件下进行。采用常压的主要原因是;该反应化学平衡常数大小关系是:K(400℃)K(500℃)(填“>”、“<”或“=”)。
②催化氧化时使用热交换器的原因是。
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。下列能用于测定硫酸尾气中SO2含量的试剂组是。(填写相应字母)
a、NaOH溶液、酚酞试液b、Na2CO3溶液、酚酞试液
c、碘水、淀粉溶液d、KMnO4溶液、稀硫酸
(14分)锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用;锂元素更是被誉为“能源元素”。
Ⅰ 锂的原子结构示意图为;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色。生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂。写出生成氮化锂的化学方程式。锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物 _____(填化学式)。
Ⅱ 下面是从锂辉石(Li2O·Al2O3·SiO2)中提出锂的工业流程示意图。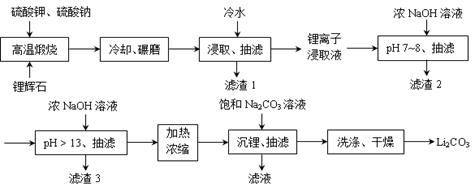
① 高温煅烧时的反应原理为:Li2O∙Al2O3∙SiO2+K2SO4= K2O∙Al2O3∙SiO2+Li2SO4;
Li2O∙Al2O3∙SiO2+Na2SO4= Na2O∙Al2O3∙SiO2+Li2SO4。
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+ 。
③几种金属离子沉淀完全的pH
| 金属离子 |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
Mn(OH)2 |
| 沉淀完全的pH |
4.7 |
9.0 |
3.2 |
10.1 |
④Li2SO4、Li2CO3在不同温度下的溶解度(g / 100g水)
| 温度 溶解度 |
10 |
20 |
50 |
80 |
| Li2SO4 |
35.4 |
34.7 |
33.1 |
31.7 |
| Li2CO3 |
1.43 |
1.33 |
1.08 |
0.85 |
(1)浸取时使用冷水的原因是。
(2)滤渣2的主要成分为。
(3)流程中分2次调节pH(pH7~8和pH > 13),有研究者尝试只加一次浓NaOH溶液使pH> 13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多。Li2CO3产品中的杂质可能是,用离子方程式表示其产生的原因。
(4)加热浓缩的作用是。
(5)洗涤Li2CO3晶体使用。
(14分)CO2和H2可用于合成甲醇和甲醚。
(1)已知①CH3OH(l)+ O2(g) ="=" CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
O2(g) ="=" CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
②H2(g)+ O2(g) ="=" H2O(g)ΔH =-241.8 kJ·mol-1
O2(g) ="=" H2O(g)ΔH =-241.8 kJ·mol-1
③H2O(g) ="=" H2O(l) ΔH =-44 kJ·mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l),同时生成H2O(l)的热化学方程式为_______。
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
已知在投料比n(CO2):n(H2)=1:3的条件下,不同温度、不同压强时,CO2的转化率见下表:
①下列关于上述可逆反应的说法正确的是
| A.在恒温、恒容的密闭容器中,当反应混合气体的密度保持不变时反应达平衡状态 |
| B.当v正(CO2)=" 3" v逆(H2),反应达平衡状态 |
| C.当n(CO2):n(H2)=1:3时,反应达平衡状态 |
| D.a > 60% |
②上述反应的化学平衡常数的表达式为__________。
③该反应的ΔH 0,原因是。
④在压强为P、温度为500K、投料比n(CO2):n(H2)=1:3的条件下,反应达平衡状态时H2的转化率为,混合气体中CO2的体积分数为。
(3)以甲醇、空气、KOH溶液为原料可设计成燃料电池:放电时,负极的电极反应式为。