Ⅰ.(8分)利用下图装置作电解50mL 0.5 mol·L-1的CuCl2溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO3-);
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:① ;
② 。
(2)分析实验记录B中浅蓝色固体可能是 (写化学式),
试分析生成该物质的原因 。
Ⅱ.(10分)A、B、C、D、E、F六种元素的原子序数依次递增,A+核外无电子,B元素的一种单质是自然界中最硬的物质,C、D、E的简单离子具有相同的核外电子排布,舍勒是D元素单质的发现者之一,戴维最早制得了E元素的单质,F元素的单质历史上曾作为流通货币,A、C、D、F四种元素形成的化合物W可用于制镜工业。
(1)D、E两元素通常可形成两种离子化合物,其中一种化合物X可用做供氧剂,X与A2D反应会产生大量气体,该气体能使带火星的木条复燃。请写出X与A2D反应的化学方程式 。
(2)A、B、D、E四种元素形成的某化合物,摩尔质量为68 g·mol-1,请用离子方程式解释其水溶液呈碱性的原因 。
(3)B、C的氧化物是汽车尾气中的主要有害物质,通过钯碳催化剂,两者能反应生成无毒物质,请写出该反应的化学方程式 。
(4)W的水溶液久置会析出一种沉淀物Z,Z由C、F两元素形成且两元素原子个数比为1:3,Z极易爆炸分解生成两种单质。请写出Z分解的化学方程式 。请从化学反应原理的角度解释Z能发生分解反应的原因 。
有A、B、C三种透明、不溶于水的坚硬固体。A在O2中完全燃烧只得到一种无色气体,此气体的密度为O2密度的1.375倍(标准状况)。B能溶于热烧碱溶液中,再往该溶液中加入过量盐酸时,析出白色胶状沉淀,它是一种比碳酸还弱的酸,分离出此沉淀物,经干燥后得到不溶于水的白色粉末,将B与石灰石、纯碱按一定比例混合高温烧熔、冷却得C,C在高温下软化,无固定熔点。根据以上事实,推断:
(1)A是________,B是________,C是________。
(2)写出有关反应的化学方程式________________________________。
化合物A、D、F是中学化学中常见的物质,化合物B、C、E中含有两种相同的元素。
这些化合物之间存在如图的关系。其中A和B的反应是一种重要化工生产中的主要反应之一。请完成下列问题:
(1)在A、C、F中含有相同的元素是__________。
(2)化合物C的化学式是________,化合物A的水溶液显__________性(填“酸”“碱”或“中”)。
(3)C的水溶液与D能否发生反应?________,理由是____________________。
氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)写出N原子结构示意图:_______,根据元素周期律知识,请写出氮化硅的化学式:_______。
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式:______________。
(3)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为______________。
根据下图所示的物质之间的转化关系,其中A为单质,回答下列有关问题。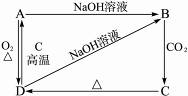
(1)写出A、B、C、D各物质的名称:
A,B,
C,D。
(2)写出下列变化的化学方程式:
D→A;
B→C;
D→B。
某型号的水泥主要成分有Ca2SiOx、Ca3SiOy、Ca3Al2Oz,则x=,y=,z=。
水泥具有水硬性,跟水掺和搅拌后很容易,水泥要保存。
普通水泥以和为主要原料,煅烧后再加入适量,用以调节硬化速度。