对于反应2C4H10(g) + 13O2(g) ="=" 8CO2(g) + 10H2O(l);△H= -5800kJ/mol,下列叙述错误的是
| A.该反应的反应热为△H= -5800kJ/mol,是放热反应; |
| B.该反应的△H与各物质的状态有关,与化学计量数也有关; |
| C.该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ; |
| D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol。 |
反应Fe(s)+CO2(g) FeO(s)+CO(g),700 ℃时平衡常数为1.47, 900 ℃时平衡常数2.15。下列说法正确的是( )
FeO(s)+CO(g),700 ℃时平衡常数为1.47, 900 ℃时平衡常数2.15。下列说法正确的是( )
| A.升高温度该反应的正反应速率增大,逆反应速率减小 |
B.该反应的化学平衡常数表达式为K=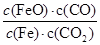 |
| C.该反应的正反应是吸热反应 |
| D.增大CO2浓度,平衡常数增大 |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) 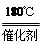 2N2(g)+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是
2N2(g)+3H2O(g) ΔH<0,在恒容的密闭容器中,下列有关说法正确的是
| A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡 |
| D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
下列关于实验现象的描述不正确的是( )
| A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 |
| C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
某研究性学习小组的课题为“MgC原电池电解淀粉KI溶液的研究”,其研究装置如图所示。下列有关说法不正确的是 ( )
| A.镁为负极,发生还原反应 |
| B.原电池中碳极反应式为Fe3++e-===Fe2+ |
| C.电解池中阳极处变蓝 |
| D.电解池中阴极处变红 |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是()
| A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe-2e-=Fe2+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |