在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。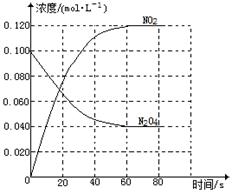
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②列式计算温度T时反应的平衡常数K2 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 ________(填“正反应”或“逆反应”)方向移动,判断理由是 。
经研究发现,长期使用我国发明的铁锅炒菜做饭,可有效地减少缺铁性贫血的发生,原因是_________________________________________________________;如果在炒菜时经常加入适量的食用醋,效果会更好,理由是________________________。
维生素C的结构简式如图所示。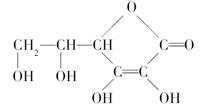
(1)维生素C的分子式是________。
(2)维生素C________溶于水(填“易”或“难”)。
(3)在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有________性。
(4)在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到溶液蓝色退去,说明维生素C具有________性。
(5)中学生每天需补充约60 mg维生素C,下列物质中含有丰富维生素C的是________。
| A.辣椒 | B.鸡蛋 | C.米饭 | D.青霉素 |
研究认为松果体分泌物——“退黑素”(英文名称melatonin,简称MLT)与人的寿命长短有关,有人把“退黑素”和克隆技术并称为“二十世纪生命科学的两大发现”。退黑素的化学结构简式如下: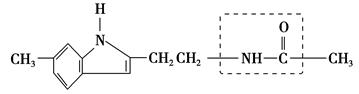
(1)退黑素的分子式为________________。
(2)退黑素结构简式中,虚线框内的结构名称为________,它在稀硫酸中受热后生成的具有酸性的物质为____________。
(1)从鸡蛋白的溶液中提取鸡蛋白的方法有________和________。
(2)鸡蛋腐败时会放出有刺激性气味的气体,该气体主要是________,说明蛋白质中含有________元素。
(3)误食重金属盐会中毒,这是因为__________________________________________。
(4)浓硝酸溅在皮肤上,使皮肤呈现________色,这是浓硝酸和蛋白质发生了________反应的缘故。
科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理,为此他们荣获了诺贝尔化学和医学奖。
请回答下列问题:
(1)已知M的相对分子质量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是____________。D是双原子分子,相对分子质量为30,则D的分子式为____________________。
(2)油脂A经下列途径可得到M。
对②的提示:
C2H5OH+HO— NO2 C2H5O— NO2+H2O
C2H5O— NO2+H2O
硝酸硝酸乙酯
反应①的化学方程式是_________________________________________。
反应②的化学方程式是_______________________________________。
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式__________________________________________。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗________ g金属钠。