过氧化镁MgO2易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等。过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用下图装置测定一定质量的样品中过氧化镁的含量。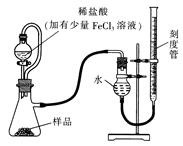
(1)实验前需进行的操作是: ,稀盐酸中加入少量FeCl3溶液的作用是: 。
(2)用恒压分液漏斗的优点有:① ;② 。
实验结束时,待恢复至室温,先 ,再平视刻度线读数。实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
(3)推算该样品中过氧化镁的质量分数 (用含a、b的表达式表示)。
方案Ⅱ:称取0.1 g样品置于某定量用锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1000 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.50 mL Na2S2O3溶液。(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
(4)该实验在滴定前需加入少量 作指示剂;判断到达滴定终点的现象是 ;
(5)推算该样品中过氧化镁的质量分数为 。
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下: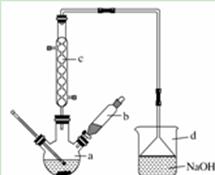
| 苯 |
溴 |
溴苯 |
|
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了_______气体。继续滴加至液溴滴完。装置d的作用是________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是___________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必需的是________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________ (填入正确选项前的字母)。
A.25 mL B.50 mL C.250 mL D.500 mL
实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混有CO2、SO2等杂质。某课外小组设计了如下装置,证明乙烯中混有CO2、SO2并验证乙烯的性质。
回答下列问题:
(1)装置A是乙烯的发生装置,图中一处明显的错误是______________________,烧瓶中碎瓷片的作用是_____________________________。
(2)若要检验A中所得气体含有SO2,可将混合气体直接通入________(填代号,下同)装置;若要检验A中所得气体含有CH2=CH2,可将混合气体先通过B装置,然后通入________装置,也可将混合气体干燥后,通入________装置。
(3)小明将从A出来的混合气体依次通过B、E、D、E,发现D前面的石灰水无明显变化、D后面的石灰水变混浊。请对出现该现象的原因进行合理猜想:
________________________________________________________________________。
(4)用离子方程式说明SO2使溴水褪色的原理___ _____。
(共8分)过氧化氢水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度, 请填写下列空白:
(1)将10.00 mL过氧化氢溶液移至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数和化学式分别填在下列横线和括号内。
MnO4- +H2O2+H+="===" Mn2++H2O+( )
(3)移取10mL过氧化氢溶液可以用_______(填“酸式”或“碱式”)滴定管。滴定到达终点的现象是___ 。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的浓度为________。
(5)若盛装高锰酸钾标准溶液的滴定管用蒸馏水洗后没有用标准液润洗,则测定结果______(填“偏高”或“偏低”或“不变”)。
如下图是实验室制备SO2并验证SO2某些性质的装置图。试回答: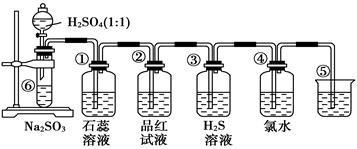
(1)⑥中发生的化学反应方程式为_____________________________。
(2)②中实验现象是,③中反应产物的化学式是
(3)⑤的作用是_____________________,反应的离子方程式为___________________。
为测定氯化亚铁和氯化铁的混合物中铁元素的质量分数,某研究小组设计了如下两种实验流程:
(1)操作Ⅱ、Ⅲ是否完全相同?________(填“是”或“否”);操作Ⅳ使用的一种主要硅酸盐材料的仪器名称是________。
(2)甲方案中沉淀A是_______(填化学式);如何判断沉淀A洗涤干净? ________________________________________________________________________。
(3)乙方案中能否用铁粉做还原剂,请用文字说明理由____________________________。
(4)写出乙方案中滴入KMnO4溶液后发生反应的离子方程式_______________________。
(5)若甲方案中红棕色固体质量为bg,乙方案滴定时消耗c mol·L-1 KMnO4溶液dmL,哪个方案测定出来的铁元素含量更准确?_______(填“甲方案”或“乙方案”);据此方案测出的铁元素的质量分数为_______(用字母表示)。