Ⅰ.下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。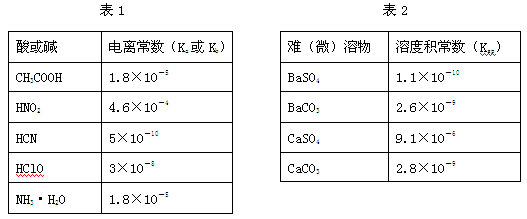
请回答下面问题:
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是 (填序号)。
| A.升高温度 | B.加水稀释 |
| C.加少量的CH3COONa固体 | D.加少量冰醋酸 |
(2)CH3COONH4的水溶液呈 (选填“酸性”、“中性”、“碱性”)。
(3)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-)达到0.0l mol/L以上,则溶液中c(CO32-)应不低于 mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g) 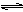 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol
在一定压强下,测得上述反应的实验数据如下表。
根据表中数据分析:
①上述反应的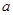 0(填“大于”或“小于”)。
0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即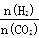 )比,平衡常数K值 (填“增大”、“减小”、或“不变”)。
)比,平衡常数K值 (填“增大”、“减小”、或“不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示: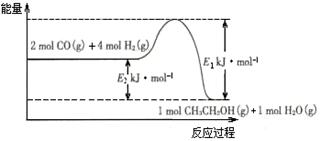
①写出CO和H2制备乙醇的热化学反应方程式 。
②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为 。
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是 。
有机物A、B、C互为同分异构体,分子式为C5H8O2,有关的转化关系如下图所示,已知:A的碳链无支链,且1 mol A能与4 mol Ag(NH3)2OH完全反应;B为五元环酯。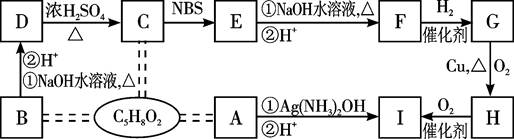
 提示:CH3—CH CH—R
提示:CH3—CH CH—R
(1)A中所含官能团是 。
(2)B、H结构简式为 。
(3)写出下列反应方程式(有机物用结构简式表示)
D→C ;
E→F(只写①条件下的反应) 。
(4)F的加聚产物的结构简式为 。
已知:(1)RCH(OH)2→RCHO+H2O
(2)C2H5OH+HO—NO2(硝酸)→C2H5O—NO2(硝酸乙酯)+H2O
现有只含C、H、O的化合物A~E,其中A为饱和多元醇,其他有关信息已注明在下图的方框内: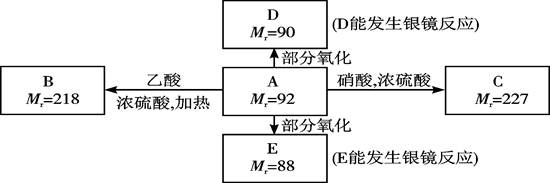
回答下列问题:
(1)A的分子式为;
(2)写出下列物质的结构简式:B;D;
(3)写出下列反应的化学方程式和反应类型(括号内):
A→C:,();
A→E:,()。
A、B、C、D、E几种常见的化合物或单质之间有如下转化关系: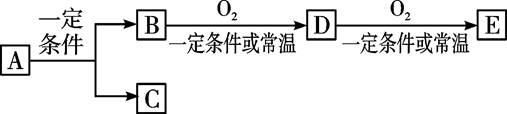
(1)若E是酸酐,D是有刺激性气味的无色气体,则B的化学式是:;工业上实现D转化为E的化工设备的名称是:;
(2)若C是酸性气体,B是碱性气体,则E是:。工业生产实际中合成B选择一定的下列条件的依据是:
①压强。
②温度。
(3)若A是日常生活中最常见的物质,C为黄绿色单质气体,则E的电子式为:;
(4)若A是某有机物,其分子空间构型为正四面体,写出下列反应的化学方程式:
A→B+C:;
B→D:。
化合物X、Y、Z是由短周期的三种元素两两结合而成,X、Y、Z之间的转化关系如右图所示(无被省略的物质):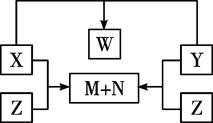
又知:X、N、W均为液态物质,且X与N的组成元素相同。试回答:
(1)上述转化关系图中涉及的基本反应类型是;
(2)X、Y、Z、W的化学式依次是:
X、Y、Z、W;
(3)写出X与Y、X与Z反应的化学方程式:
X+Y:;
X+Z:。
化学实验兴趣小组在实验室进行氢气在氯气中的燃烧实验。设计如下图所示装置I制备和收焦干燥纯净的氯气以备后续实验;

烧瓶中发生反应的离子方程式为;
请根据实验目的将装置I中虚线框内装置补充完整并在括号内注明所需试剂;在右图所示装置Ⅱ中,在试管中先加入过量铁粉,再滴入少量CaSO4溶液,最后加入一定量稀盐酸,塞上胶塞,观察到有大量气泡产生。
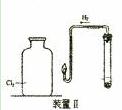
①检查制取氢气装置气密性的操作方法是
②当点燃氢后,将导管伸入盛有氯气的集气瓶中,观察到的现象是当氢气停止燃烧后,取出导管,同学们进行了分组探究实验。A组同学发现制氢气后的试管中还有较多固体剩余,同学们将足量氯气通入试管中,发现固体全部消失,但未观察到有气泡产生,请解释可能原因(用离子方程式表示);;B组同学向集气瓶中注入适量水,用力振荡后,向中满入少量Na2SO3溶液,发现溶液中没有出现黄色沉淀,但再向溶液中滴入稀盐酸酸化的氯化钡溶液后,生成了白色沉淀。[已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O],同学们分析是由于集气瓶中还有少量氯气残留的缘故。可以解释该实验现象的两个离子方程式是:
①
②