锰的化合物种类较多,也大多具有广泛的用途。
I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是_____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2 SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在
室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:
| 试管编号 |
实验现象 |
| A |
溶液不变色 |
| B |
溶液缓慢变浅棕褐色 |
| C |
溶液迅速变棕褐色 |
从以上实验中,我们可以得出的结论是____________。
②写出C试管中发生反应的离子方程式:________________。
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:

已知Fe3+、Mn2+沉淀的pH如表所示。
| |
开始沉淀 |
完全沉淀 |
| Fe3+ |
2.7 |
4.2 |
| Mn2+ |
8.3 |
10.4 |
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为___________________。
②步骤二中需控制pH的范围是_______________
③步骤三中是否洗涤干净的判断方法是_____________.
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示: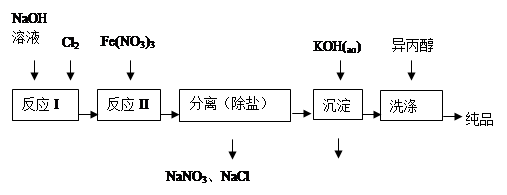
①洗涤粗品时选用异丙醇而不用水的理由是:。
②反应II的离子方程式为。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为它能净水的原因是。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是:。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠(填“大”或“小”)。
| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式:。
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。目前降低尾气的可行方法是在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g)△H=-a kJ·mol-1。
N2(g)+2CO2(g)△H=-a kJ·mol-1。
(1)CO2的电子式为 。
(2)已知2NO(g)+O2(g)=2NO2(g)△H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学反应方程式 。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
①有害气体NO的转化率为,0~15min NO的平均速率v(NO)=。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将移动(选填“向左”、“向右”或“不”), 移动后在达到平衡时的平衡常数是。
已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为:,该反应的Q0。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g), 发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4min时平均反 应速率v(CO)=。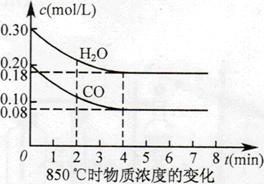
(3)若在500 时进行,且CO、H2O(g)的超始浓度均为0.020mol/L,该条件下,CO的最大转化率为。
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为。
(5)某电化学装置可实现2CO2=2CO+O2的转化,使CO重复使用。已知该反应的阳极反应为4OH—-4e—=2H2O+O2,则阴极反应式为。
(6)有人提出可以设计反应2CO=2C+O2(ΔH>0)来消除CO的污染,请判断上述反应能否发生(填“可能”或“不可能”),理由是。
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。
已知:
A为金属单质,B为红褐色固体,E为密度最小的气体,G为浅绿色的溶液。
D的水溶液为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
在水溶液中D能将某氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)构成C物质的元素在周期表中的位置是,在短周期主族元素中,该元素与其相邻元素的原子半径从大到小的顺序是(用元素符号表示)。
(2)D的水溶液呈性,请用离子方程式解释原因:。
(3)上述反应中属于置换反应的是(填序号)。
(4)反应③(即D将某种氧化物氧化为F)的离子方程式:。
(5)对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023个。请按照要求填空:
| 实验步骤 |
实验现象 |
写离子方程式 |
| 将少量气体通入淀粉KI溶液 |
溶液最初变成色 |
|
| 继续通入气体 |
溶液逐渐变成无色 |
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
| 周期 |
ⅠA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)请画出元素⑥的离子结构示意图:。
(2)元素⑦中质子数和中子数相等的同位素符号是:。
(3)④、⑤、⑦的离子半径由大到小的顺序为:。
(4)②的最高价氧化物对应水化物的电离方程式为:。
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为:。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为:。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量,写出A与B反应的热化学方程式:。