(1)①1.5molH2SO4的质量是____________;
②9.03×1023个氨分子中的质子物质的量是_________;
③标况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为_______________;
④71.5g碳酸钠晶体(Na2CO3·10H2O)溶于水,配成500ml溶液,此溶液的物质的量浓度为______________。
(2)现有①铁片 ②饱和食盐水 ③液态氯化氢 ④乙醇 ⑤干冰 ⑥熔融KNO3⑦BaSO4固体⑧石墨 ⑨苛性钠,其中属于电解质的是_______________,属于非电解质的是__________,能导电的是_____________________
(3)写出下列反应的离子反应方程式:
①少量二氧化碳通入澄清石灰水中:____________________________________________
②向硫酸氢钠溶液中不断加入氢氧化钡溶液至沉淀完全:__________________________
(10分)(化学-有机化学基础)下图中X是一种具有水果香味的合成香料,A是有直链有机物,E能与溴水反应产生白色沉淀。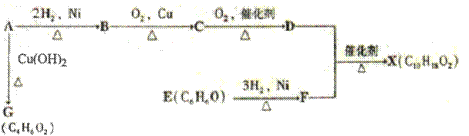
请根据上述信息回答:
(1)A中含氧官能团的名称是,A→G的反应类型为。
(2)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为。
(3)D和F反应生成X的化学方程式为,B到C化学反应方程式
(12分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 6SO2+Fe3O4,氧化产物为,若有3 mol FeS2参加反应,转移mol电子。
6SO2+Fe3O4,氧化产物为,若有3 mol FeS2参加反应,转移mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为(用离子方程表示)
(4)①钢铁的电化腐蚀简单示意图如下,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向。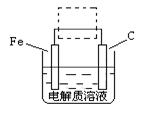
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式。
(5)铁红是一种红色颜料,其成分是Fe2O.3将一定量的铁红溶于160ml5 mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为。
下图表示几种中学常见物质之间的相互转化关系(图中部分条件或产物已省略),其中B为固体单质,D为红棕色气体,E在通常状况下是无色无味的液体,G是淡黄色的固体化合物,H是黑色晶体。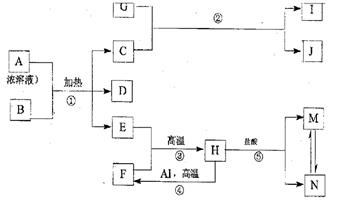
请回答下列问题:
(1)单质F的组成元素在周期表中的位置是(指明周期和族),化合物Ⅰ的俗名。
(2)金属Al和H的混合物俗称,引发该反应的操作是。
(3)写出上图中下列反应的化学方程式:
① ;
③ ;
(4)实验室中,应将X的浓溶液保存在试剂瓶中,其原因是(用化学反应方程式表示)
(5)向上图中的反应⑤得到的M、N混合液中通入SO2气体,酸性增强。请写出该过程发生反应的离子方程式:。
(13分)二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中能导致光化学烟雾的形成;
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:CO(g)+NO2(g)NO(g)+CO2(g) △H=-akJ·mol—1(a>0)2CO(g)+2NO2(g)N2(g)+2CO2(g) △H=-bkJ·mol—1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为mol,放出的热量为kJ(用含有a和b的代数式表示)。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为(只要求写一种)。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,SO2(g)+1/2O2(g)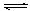 SO3(g);△H=" —98" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=。
SO3(g);△H=" —98" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=。
②一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)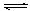 2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
A.保持温度和容器压强不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
E.升高温度 F.移动活塞压缩气体
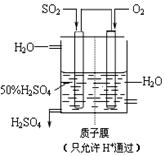
(4)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
。
[选修物质结构].铁是地球表面最丰富的金属之一,能形成多种配合物,铁系催化剂是工业生产中常用的催化剂。
(1)合成氨工业使用的催化剂是以铁为主体的多成分催化剂。
①NH3中N原子的杂化轨道类型是。
②N与O同属第二周期,N的第一电离能比O大的原因是。
③根据等电子体原理,写出一种NH4+是等电子体的微粒的化学式____________。
(2)二茂铁[(C5H5)2Fe]是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如右所示,其中氢原子的化学环境完全相同。
①Fe的基态电子排布式为____________。
②二茂铁中Fe2+与环戊二烯离子(C5H5-)之间的化学键类型是 _______________。
③1mol环戊二烯( )中含有σ键的数目为_________个。
)中含有σ键的数目为_________个。
(3)普鲁士蓝俗称铁蓝,结构如图所示,K+未画出),每隔一个立方体在立方体中心含有一个K+离子,普鲁士蓝中铁元素的化合价有+2和+3两种,其中Fe3+与Fe2+的个数比为:_____________。