(15分)有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应的实验过程可用如图表示:
请回答下列问题: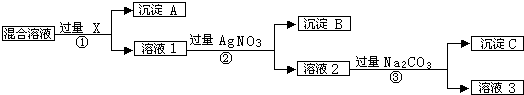
(1)写出实验流程中下列物质化学式:试剂X ,沉淀A ,沉淀B 。
(2)①、②、③过程中均需要过滤,在进行此操作时需要用到的玻璃仪器为: 、 、 。
(3)上述实验流程中加入过量的Na2CO3的目的是 。
(4)按此实验方案得到的溶液3中肯定含有Na2CO3杂质;为了解决这个问题,可以向溶液3中加入适量的 ,之后若要获得固体NaNO3需进行的实验操作是 (填操作名称)。
铁及其化合物与生产、生活关系密切,请回答下列问题:
(1)印刷电路板是有高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”。请你写出该反应的离子方程式:___________________。
(2)工业上可用废铁屑制铁红(Fe2O3),生产中首先用废铁屑与HNO3反应制得Fe(NO3)2。写出稀HNO3与过量Fe反应的离子方程式:___ _;从“绿色化学”思想看制备Fe(NO3)2应用浓HNO3还是稀HNO3?并说明理由:______________________
(3)高铁酸盐(FeO42-)是一种新型净水剂,既能净水又能杀菌。请运用所学知识推测高铁酸盐(FeO42-)能用于自来水杀菌消毒的原因:__________。制备它的一种方法是用Fe2(SO4)3和NaClO在强碱性溶液中反应,写出反应的离子方程式:_________________________。
(4)在一定体积的含有Al3+、Fe3+、Ba2+的混合溶液中逐滴加入NaOH和NaSO4的混合溶液(除上述离子外,其他离子不与所加试剂反应),产生沉淀的物质的量与所加溶液的体积的关系如图所示: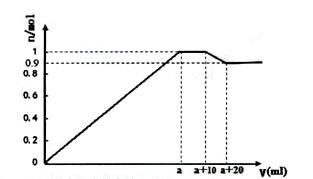
①写出(a+10)到(a+20)过程中反应的离子方程式:_____________
②NaOH和Na2SO4的混合溶液中c(NaOH) c(Na2SO4)(填>、<或=)
③上述含Al3+、Fe3+、Ba2+的混合溶液中n(Al3+)=mol
在1.0L密闭容器中放入l.0molX(g),在一定温度进行如下反应:
X(g) Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
回答下列问题:
(1)实验测得,随温度的升高反应的平衡常数K增大,则△H_______0(填>、<或=)
(2)其他条件不变时,为使平衡向右移动,采用的下列措施可行的是________________。
| A.缩小容器容积 |
| B.及时分离出Y、Z |
| C.使用合理的催化剂 |
| D.升高体系温度 |
(3)计算平衡时X的转化率为__________,该温度下反应的平衡常数值为:______________。
(4)由总压强p和起始压强po表示反应体系的总物质的量n(总)和反应物X的物质的量n(X),则n(总)=__ mol,n(X)=__ mol,反应物X的转化率a(X)的表达式为_____________。
二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义。
(1)二氧化氮与一定量空气混合通入水中能被水完全吸收,反应的化学方程式为_______________。若该反应有a×NA个电子转移,则参加反应的二氧化氮的物质的量为___________。
(2)下列除去大气污染物的化学方程式不正确的是___________。
A.汽车尾气经催化剂作用:CO+NO NO2+C
NO2+C
B.石灰乳吸收硫酸厂尾气:SO2+Ca(OH)2=CaSO3+H2O
C.燃烧法除去尾气中硫化氢:2H2S+3O2 2SO2+2H2O
2SO2+2H2O
D.氨气与一氧化氮在一定条件下反应:4NH3+6NO 5N2+6H2O
5N2+6H2O
(3)大多数非金属氧化物能被氢氧化钠溶液吸收。例如,NaOH+SO2=NaHSO3,2NaOH+SO2=Na2SO3+H2O,
2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O,NO不溶于氢氧化钠溶液或水。
①同种反应物,其反应产物与浓度、温度、反应物相对量等因素有关。影响二氧化硫与氢氧化钠反应产物的因素与下列反应相同的是___________。
A.木炭与氧气反应
B.硫与氧气反应
C.钠与氧气
D.铜与硝酸溶液反应
②某NO与NO2混合气体通入氢氧化钠溶液被完全吸收,推测混合气体中气体组成为________。
A.  =1B.
=1B.  ≤1
≤1
C.  ≥1 D.无法判断
≥1 D.无法判断
某学习小组为探究胶体的性质进行如下实验:
(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式是:____________,反应后得到的溶液呈________色。
(2)取少量上述溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为______________________。
(3)在小烧杯中加入20 mL 蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈__________色,即制得Fe(OH)3胶体。
(4)取上步实验烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化。
①先出现红褐色沉淀,原因是________________________。
②随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式:________________________。
③最后溶液颜色加深,原因是_____________________________。(用离子方程式表示)。
④用稀盐酸代替稀HI溶液,能出现上述哪些相同的变化现象?________(写序号)。
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-、SiO32-中的若干种组成(不考虑水的电离)。取该溶液进行如下实验:
Ⅰ.取适量溶液,加入过量的盐酸,有气体生成,并得到无色溶液;
Ⅱ.在Ⅰ所得溶液中加入过量的NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
Ⅲ.在Ⅱ所得溶液中加入过量的Ba(OH)2溶液,加热,也有气体生成,同时析出白色沉淀乙。
请回答下列问题:
(1)由实验Ⅰ可知原溶液中一定不含有的离子是__________;一定含有的离子是______。
(2)由实验Ⅱ可知原溶液中还一定含有的离子是________;生成甲的离子方程式为______________。
(3)实验Ⅲ中生成白色沉淀乙的离子方程式为_____________________。
(4)原溶液中还可能存在的离子是________;检验该离子的方法是____________________。