某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:(已知乳酸酸性强于碳酸)
已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O →TiO2 • xH2O↓+H2SO4。
请回答:
(1)步骤①所得滤渣的主要成分为 ,分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是 ;步骤②中得到纯净硫酸亚铁晶体的操作为蒸发浓缩、 。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 。
(3)步骤④的离子方程式是 。
(4)试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因: 。
(5)实验室中常用KMnO4滴定法测定晶体中FeSO4·7H2O的质量分数,取步骤②中所得FeSO4·7H2O晶体样品a g,配成500.00 mL溶液,取出25.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液25.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) 。
化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3+H2O 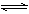 NH3·H2O
NH3·H2O 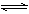 NH
NH +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向______移动,OH-的浓度_____,NH4+的浓度_______。
(2)向氨水中加入浓盐酸,平衡向______移动;
(3)向浓氨水中加入少量NaOH固体,平衡向_____移动,此时发生的现象是__________。
将含有Ag+、Mg2+、Al3+、Na+等离子的稀溶液,按下列实验步骤进行离子的依次分离。填写下列空白(各步可使用的试剂限于在NaOH、HCl、NaCl中选择)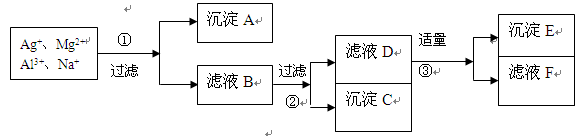
(1)沉淀A是 ___,沉淀C ___,沉淀E是;
(2)加入试剂①是 ____,②是________________,③是______________。
某种常见的白色晶体A,与盐酸反应产生无刺激性气味的气体B,将B通入澄清石灰水,石灰水变浑浊。若在A的水溶液中加氢氧化钡溶液微热,则析出白色沉淀C和无色气体D,D可以使湿润的红色石蕊试纸变蓝。加热固体A,可生成水、B和D,而且B和D的物质的量之比为1:1.根据以上事实,可以判断出A是,B是,C是。
加热固体A生成水、B和D的化学方程式是_____________,
A与盐酸反应的离子方程式___________________________________,
A与氢氧化钡溶液反应的离子方程式_______________________________________________。
如右图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由_______________逐渐变为_______色,试管内的液面会逐渐_____________,剩余气体约占试管容积的__________,用化学方程式表示这种变化__________________________;上述反应停止后向试管中缓慢通入氧气,气体颜色又由______色逐渐变为____________色,之后又变为______色,继续通入氧气,直到试管中充满液体为止,用一个化学方程式表示试管中发生的化学反应_____________________________________。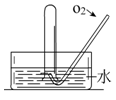
我国使用最早的合金是_____________,目前用量最大,使用最广泛的合金是___________。合金的硬度一般比它的各成分金属的硬度_________,多数合金的熔点一般比它的各成分金属的熔点___________。镁铝合金投入氢氧化钠溶液中,反应的化学方程式为__________________________,红热的铁片投入水中,表面生成一层黑色晶体,反应的化学方程式为___________________________。