利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
根据设计要求回答:
(1)B装置有三种功能:①干燥气体;②________;③________。
(2)设V(Cl2)/V(CH4)=x,若测得通入1molCH4得到四种有机产物物质的量相等,则理论上x值应为________。
(3)D装置的石棉中均匀混有KI粉末,其作用是_____________________________________。
(4)E装置的作用是___________________(填编号)。
| A.收集气体 | B.吸收氯气 | C.防止倒吸 | D.吸收氯化氢 |
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式________________________________。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a.CH4
b.CH3Cl
c.CH2Cl2
d.CHCl3
e.CCl4
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
(1)该同学的实验目的是;
要得出正确的实验结论,还需控制的实验条件是。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验可选用的实验药品是;
应该测定的实验数据是。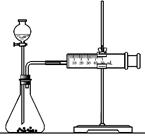
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般可采用下列反应合成甲醇:
CO(g) + 2H2(g)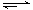 CH3OH(g) ΔH
CH3OH(g) ΔH
①下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.04 |
0.25 |
0.012 |
由表中数据判断ΔH 0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,5min该反应达到平衡,测得c(CO)= 0.2 mol/L,则用H2表示的5min内该反应的反应速率为,此时的温度为(从上表中选择)。
③300℃时,向2L的密闭容器中投入CH3OH(g)发生反应I,达平衡时CH3OH(g)的分解率是50%,求起始投入CH3OH(g)的物质的量mol。
(2)在压强为0.1 MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可增加甲醇产率的是。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
已知水在25℃和95℃时,其电离平衡曲线如下图所示:
(1)则25℃时水的电离平衡曲线应为(填“A”或“B”)。
(2)95℃时水的离子积KW=。
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为。
(4)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是。
(5)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:。
现有25℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中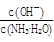 (增大、减小、不变)
(增大、减小、不变)
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
所得溶液的pH7(填“>”“<”或“=”)。
(3)若向该氨水中加入氢氧化钠固体,则该电离平衡向方向移动(分子化、离子化),电离平衡常数。(增大、减小或不变)
一定温度下在10L容器中加入5molSO2和3molO2,当反应达到平衡时,有3molSO2发生反应。
(1)生成了molSO3,SO2的转化率为。
(2)平衡时容器内气体的总物质的量为mol。
(3)平衡时SO2的浓度是mol/L。