亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。
它在碱性环境中稳定存在。
(1)NaClO2中Na、Cl、O原子半径由大到小的顺序为________________________,Cl元素在周期表中的位置为_______________________。
(2)NaClO2变质可分解为NaClO3和NaCl。分别取等质量未变质和部分变质的NaClO2试样配成溶液,与足量FeSO4溶液反应,消耗Fe2+的物质的量_____________(填相同、不相同)。
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaC1O2+4HCI= 5NaCl+4C1O2↑+2H2O该反应中氧化剂和还原剂的物质的量之比是___________。
(4)常温时,HCIO2的电离平衡常数Ka=1.07×10-2 mol·L-1。
①NaClO2溶液中离子浓度大小顺序为__________________________________。
②常温时,l00mL 0.0lmol/L HClO2溶液与l0mL 0.1mol/L HClO2溶液相比,下列数值前者大于后者的有_ ________________,
| A.ClO2-的物质的量 | B.c(OH -) | C.电离平衡常数 | D.c(HClO2) |
③NaClO2溶液(含少量NaOH)的pH=13,则溶液中 =___________。
=___________。
写出下列反应的化学方程式,并指出反应类型:
(1)实验室制乙烯 ()
(2)用甲苯制备TNT ()
(3)苯酚和浓溴水的反应 ( )
(4)1,2-二溴乙烷与足量氢氧化钠的乙醇溶液加热: ()
(5)2-丙醇与氧气在催化剂作用下反应 ( )
下图是某烃A分子的球棍模型。回答下列问题:
(1)A的名称是________________________;
(2)A能够发生的反应类型有____________(填序号);
A. 氧化反应 B. 加成反应 C. 消去反应
(3)A与溴的四氯化碳溶液反应的化学方程式是________________________________。
氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知: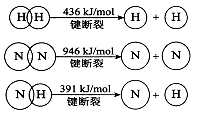
①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K (填“增大”、“减小’’或“不变”)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。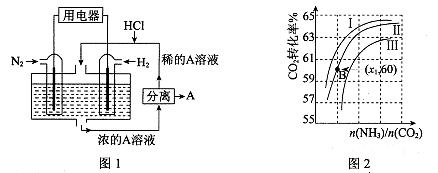
(4)用氨合成尿素的反应为2NH3(g)+CO2(g)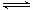 CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比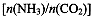 、水碳比
、水碳比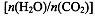 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)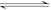 N2(g)+CO2(g)△H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)△H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 浓度 浓度 |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数表达式K= 。
②30min后,只改变某一条件,反应重新达到平衡,
根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入合适的催化剂 b.加入一定量的活性炭
c.通入一定量的NO d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,
Q 0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.混合气体的平均相对分子质量不再改变
c.反应体系的压强不再发生改变
d.混合气体的密度不再发生改变
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液 (填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”)。
(2)某温度下,若向0.1 mol/L的NaHA溶液中滴入0.1 mol/L KOH溶液使混合溶液中c(H+)=c(OH-),则此时该混合溶液中,下列关系一定正确的是 (填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)="0.05" mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH>0
Ca2+(aq)+A2-(aq) ΔH>0
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+) 。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式: 。