(9分)氮及其化合物在很多方面有重要的用途。
(1)氮的氧化物有多种。现有NO和NO2的混合气体,其中N 、O元素质量之比为7:12,则该混合气中NO和NO2的物质的量之比为 。
(2)氨气的实验室制法有多种,若不加热,制取氨气所用试剂可以用浓氨水和生石灰,产生氨气的原因是: ;氨气的检验方法是: 。
(3)硝酸具有很强的氧化性,王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属。铂溶于王水时产生[PtCl6]2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式 。
(4)氮的一种氢化物肼(即N2H4)用作发射卫星的燃料。
已知: N2 + 2O2 = 2NO2 N2H4 + O2 = N2 + 2H2O
发射卫星用气体肼为原料,以NO2为氧化剂,两种物质反应生成氮气和水蒸气,反应中每有4mol电子转移,则生成N2质量为 g。
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(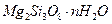 )等化合物。
)等化合物。
(1)三硅酸镁的氧化物形式为_______
(2)铝原子的原子结构示意图为,写出氢氧化铝与胃酸反应的离子方程式。
(3)Al2O3、MgO和SiO2都可以制耐火材料, 其原因是______。
| A. Al2O3、MgO和SiO2都不溶于水 | B.Al2O3、MgO和SiO2都是白色固体 |
C.Al2O3、MgO和SiO 2都是氧化物 2都是氧化物  |
D.Al2O3、MgO和SiO2都有很高的熔点 |
某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x的值。通过查阅资料该小组同学得知:草酸易溶于水,其水 溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+
溶液可以与酸性KMnO4溶液发生反应2MnO4-+5H2C2O4+6H+2Mn2++10CO2↑+8H2O。该组同学利用该反应原理设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,实验记录有关数据如下:
| 滴定次数 |
待测草酸溶液体积(mL) |
0.1000 mol/LKMnO4标准溶液体积(mL) |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 第一次 |
25.00 |
0.00 |
10.02 |
| 第二次 |
25.00 |
0.22 |
11.32 |
| 第三次 |
25.00 |
1.56 |
11.54 |

请回答:
(1)滴定时,将KMnO4标准液装在右图中的(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志可以是。
(3)通过上述数据,计算出x=。
(4)①若滴定终点时俯视滴定管刻度,则由此测得的x值会(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会。
如图所示,甲、乙两池电极材料都是铁棒和石墨棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是__________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式______________________________。
②甲池中石墨电极上的电极反应属于______(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池石墨电极附近,发现试纸变蓝,反应的化学方程式为__________________________________。
④若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混合匀后的pH=_______。
目前工业上有一种方法是用CO2来生产燃料甲醇。
CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:
CH3OH(g)+H2O(g)ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:
在体积为1 L的密闭容器中,充入1mol CO2和4 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。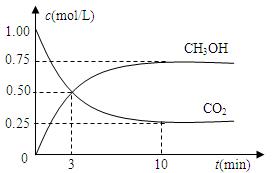
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=mol/(L·min)。
(2)该反应的平衡常数表达式为。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是。
A.升高温度 |
B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1 mol CO2和4 mol H2 |
(4)如果在相同的容器中事先充入1 mol CH3OH和1 mol H2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为。
mol CH3OH和1 mol H2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为。
能源是人类生存和发展的重要支柱。研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义。
(1)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g)ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g) =CO(g)ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g)ΔH=kJ/moL
(2)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
① 图中反应的ΔH=kJ/mol(用含有E1、E2代数式表示)。
② 已知热化学 方程式:H2(g)+1/2O2(g) =H2O(g)ΔH=-
方程式:H2(g)+1/2O2(g) =H2O(g)ΔH=- 241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为kJ/mol。
241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为kJ/mol。
③ 图中虚线(II)与实线(I) 对于同一反应具有的意义:
。