(12分)【化学——有机化学基础】
“心得安”是治疗心脏病的药物,下面是它的一种合成路线(具体反应条件和部分试剂略):
回答下列问题:
(1)试剂a是_________________。
(2)③的反应类型是______________。
(3)试剂b可由丙烷经三步反应合成:
反应l的试剂与条件__________________;
反应2的化学方程式为_______________________________________________;
反应3的反应方程式为_______________________________________________。
(4)芳香化合物D _____(填“是”或“不是”)1—萘酚的同分异构体。
_____(填“是”或“不是”)1—萘酚的同分异构体。
右边图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色反应均为黄色。
请填写下列空白: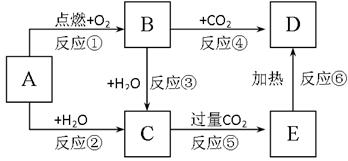
(1)写出化学式:
A 、B、
C 、D 。
(2)以上反应中属于氧化还原反应的有。(填写编号)
(3)写出A → C反应的离子方程式;
E → D的化学方程式。
将500mL0.1mol/L的CuSO4溶液和500mL4mol/L的NaCl溶液相混合,然后用石墨电极进行电解,电解过程中共有0.4mol电子通过。试计算:
(1)阴极上可析出铜克。
(2)在标准状况下阳极上可以产生毫升气体。
(3)假设电解过程中溶液体积的变化忽略不计,则当有0.2 mol电子通过时,溶液的PH为。
已知,当羟基与双键碳原子相连接时,易发生如下转化: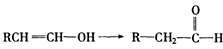 化学式为C8H8O2的有机物有如下的转化关系:
化学式为C8H8O2的有机物有如下的转化关系: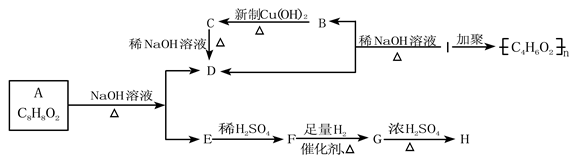
其中F能与FeCl3溶液显紫色,I为一种不饱和酯。
回答:
(1)结构简式E,B,I。
(2)写出反应类型:B→C; G→H。
(3)写出下列反应的化学方程式
①A→D+E。
②B→C。
(4)写出与A具有相同官能团、且属于芳香族化合物的同分异构体的结构简式(不含A):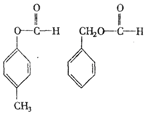
、、。
某无色溶液可能是由Na2CO3、 NaOH 、MgCl2、AlCl3、BaCl2 、Fe2(SO4)3 、(NH4)2SO4溶液中的两种或两种以上混合而成。取该溶液少许于试管,向其中加入H2SO4,有白色沉淀生成,继续加入H2SO4时沉淀又完全消失,整个实验过程中无气体产生,则原溶液是由和混合而成。实验过程中有关的离子反应方程式是
有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E
的顺序增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;CB可与EA2
反应生成C2A和气态物质EB4;E的M层电子数是K层电子数的2倍。
(1)写出下列元素的名称:A_______,B_______, E_______。
(2)画出E的原子结构示意图_______。
写出电子式D2A2_______,EB4_______。
(3)比较EA2与EB4的熔点高低(填化学式)_______>_______。
(4)A的氢化物的沸点与同族下一周期元素的氢化物相比,A的氢化物的沸点(填“高”或“低”),原因是。