(12分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置: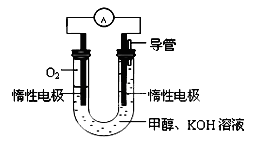
①工作一段时间后,测得溶液的pH减小。请写出该电池的负极的电极反应式。
②用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为 mol/L(假设电解前后溶液体积不变)。
(10分)中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为 ,B体现出的化学性质有 。
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为 。
(3)若A为某不活泼的金属单质,该反应能产生一种造成光化学烟雾(NO2)的气体,该反应中氧化剂与还原剂的物质的量之比为
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
写出A与X的溶液反应的离子方程式
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):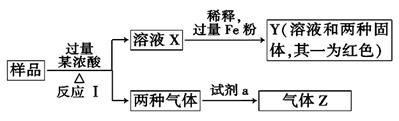
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)___________。
(2)Z为一种或两种气体
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是_________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是_____________。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)_____________。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I- 时,共转移3 mol电子,该反应的离子方程式是_______________。
1000mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
| 阳离子 |
K+、NH4+、Fe3+、Ba2+ |
| 阴离子 |
Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(所加试剂均过量):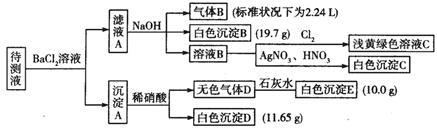
(1)写出生成白色沉淀B的离子方程式:_______________。
(2)待测液中肯定不存在的阳离子是_____________。
(3)若无色气体D是混合气体:
①待测液中一定含有的阴离子是__________。
②沉淀A中能还原稀硝酸的成分是________________(写化学式)。
2015年8月12日晚11时20分左右,天津港国际物流中心区域内瑞海公司所属危险品仓库发生的爆炸,造成了严重的人员伤亡,据瑞海国际官网信息,该公司仓储含有以下种类物质:压缩气体天然气、易燃液体乙酸乙酯、遇湿易燃物品电石、氰化钠、腐蚀品硫化碱等。
(1)由于CaC2、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难。如果在实验室,你处理金属钠着火的方法是 。(填序号)
A.泡沫灭火器 B.消防车喷水 C.沙土
(2)硫化碱其实就是我们常见的硫化钠,触及皮肤和毛发时会造成灼伤。①其水溶液呈强碱性,故俗称硫化碱。 ②其水溶液在空气中会缓慢地氧化成Na2S2O3,该反应中还原剂与氧化剂物质的量之比为 。
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染。处理NaCN的方法有多种,方法一:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 。
方法二:这些泄露的氰化钠将通过喷洒双氧水的方式来处理,用双氧水处理后会释放氨气同时生成无毒的碳酸氢钠,以减轻污染。则CN- 被氧化生成的产物为 。
(4)环保部门为测定H202溶液浓度,方法如下:用移液管吸取10. 00mL的H2O2样品盛入l00ml容量瓶中,加水稀释至刻度线,取25.OOmL溶液盛入锥形瓶里,再加入lOmL 3mol/L稀硫酸(过量),用0.02mol/L的标准浓度的KMnO4溶液滴定,所用体积为20.00ml,试写出与H2O2 相等电子数的三原子分子的化学式 。原H2O2溶液的浓度为 mol/L。
[物质结构与性质]下列反应曾用于检测司机是否酒后驾驶:
2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为_______ __;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________(填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为___________;1molCH3COOH分子中含有δ键的数目为 _____ _。
(3)与H2O互为等电子体的一种阳离子为_____ ___(填化学式);H2O与CH3CH3OH可以任意比例互溶,除因为它们都是极性分子外,还因为_____ ___。