(14分)汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图: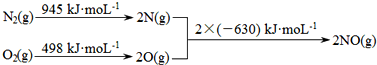
则该反应的热化学方程式为 。
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ="=" 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积 L。
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);△H= -b kJ•mol-1
CH3OH(g);△H= -b kJ•mol-1
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增加甲醇产率的是 。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1 mol CO和3 mol H2 |
③经测定不同温度下该反应的平衡常数如下:
| 温度(℃) |
250 |
300 |
350 |
| K |
2.041 |
0.270 |
0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1,则此时v正 v逆(填>、<或=)。
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为_____________________________。电池工作时,固体电解质里的O2-向_______极移动。
①将一小块金属钠投入足量的MgSO4溶液中,现象是:
②用离子方程式解释以上现象:、;
③当金属钠着火时,应选用的灭火材料是
| A.干冰灭火剂 | B.水 | C.干燥沙土 | D.泡沫灭火器 |
(1)制印刷电路时常用氯化铁溶液作为“腐蚀液”。铜被氯化铁溶液腐蚀的方程式为:B2FeCl3+Cu=2FeCl2+CuCl2;氯化铁溶液也能与铁反应:2FeCl3+Fe=3FeCl2;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部可能出现的情况是(多选)
| A.有铜无铁 | B.有铁无铜 | C.有铁有铜 | D.无铁无铜 |
请把铜被氯化铁溶液腐蚀的化学方程式改写为离子方程式:
、
(2)某河道两旁有甲乙两厂。它们排放的工业废水中,共含有K+、Ag+、Fe3+、C1—、OH—、NO3—六种离子。若测得甲厂的废水明显呈碱性,则可推知乙厂废水中所含的三种离子是。
4分)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S ="=" K2S+2NO2↑+CO2↑。在该反应中KNO3表现出性,被还原的元素是。
铝是生活中很常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,可在生活中应用很广泛,原因是
。
(2)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示) ;
;
(3)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为。
有以下物质①Fe、②AgCl固体、③ 熔融Ba (OH)2、④Al2(SO4)3溶液、⑤SO2、⑥蔗糖溶液、⑦食盐水、⑧ H2CO3、⑨无水乙醇(C2H5OH)。其中能导电的物质有(填数字序号,下同):;属于非电解质的有;属于电解质的有_______,请写出其中一种电解质在水溶液中的电离方程式
(OH)2、④Al2(SO4)3溶液、⑤SO2、⑥蔗糖溶液、⑦食盐水、⑧ H2CO3、⑨无水乙醇(C2H5OH)。其中能导电的物质有(填数字序号,下同):;属于非电解质的有;属于电解质的有_______,请写出其中一种电解质在水溶液中的电离方程式