某校化学研究性学习小组进行淀粉水解反应的探究实验.该小组的实验操作流程如下:
请回答以下问题:
(1)所加入的试剂分别是A ,B ,C ;(填化学式)
(2)加入B的原因是 ;
(3)由此可知淀粉是 (填“部分”、“完全”或“没有”)水解。
Q、W、X、Y、Z为五种原子序数依次增大的短周期元素。已知:
①Q原子的核外电子数等于电子层数,且与W组成的一种化合物是沼气的主要成分;
②元素X的最高价氧化物的水化物和其气态氢化物能够反应,生成离子化合物甲;
③W与Y组成的化合物乙,是机动车排出的大气污染物之一,也是造成“雾霾”天气的物质之一;
④Y与Z能形成电子总数为30和38的两种离子化合物,分别为丙和丁。
(1)丁的电子式是 __________。
(2)WY2与Z2Y2反应的化学方程式是_________________________________________。
(3)甲在水溶液中的水解方程式为______________________________________。
(4)写出一种实验室制取XQ3的方法__________________________________。(用化学方程式表示)
(5)标准状况下22.4L X的气态氢化物,与0.5L 1mol/L的X最高价氧化物的水化物反应,所得溶液中离子浓度由大到小的顺序是________________________________________(用化学式表示)。
28某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下: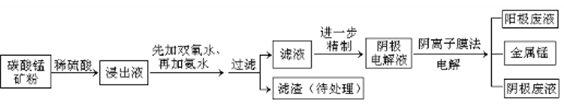
阴离子膜法电解装置如图所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式。
(2)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因.
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
加氨水调节溶液的pH等于6,则滤渣的成分是,滤液中含有的阳离子有H+和 。
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是极。实际生产中,以石墨为电极,阳极区以稀硫酸为电解液,阳极的电极反应式为。
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式。
27.氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用。试回答下列问题:
(1)N2和H2为原料合成氨气的反应为:N2(g)+3H2(g)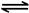 2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号)。
2NH3(g) △H<0,下列措施可以提高H2的转化率是(填选项序号)。
a.选择适当的催化剂b.增大压强
c.及时分离生成的NH3d.升高温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N2)=1.0mol,n(H2)=1.0mol,n(NH3)=0.4mol,则反应速率v(N2)=mol/(L·min)。
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)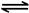 2NO2(g) △H>0
2NO2(g) △H>0
该反应的反应速率(v)随时间(t)变化的关系如下图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)。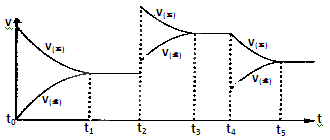
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0-t5时,容器内NO2的体积分数在t3-t4时值的最大
(4)氨和联氨(N2H4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:。
(5)已知:N2(g)+O2(g) = 2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
若有17 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为。
(6)直接供氨式碱性燃料电池的电池反应式是4NH3 + 3O2 = 2N2 + 6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是.从理论上分析,该电池工作过程中(填“需要”或“不需要”)补充碱(KOH).
26.铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式;
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因。
(3)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式________________________。
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
□Cu2S+□HNO3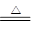 □CuSO4 +□ Cu(NO3)2+□NO↑+ □
□CuSO4 +□ Cu(NO3)2+□NO↑+ □
(5)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g。向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为(填化学式)。
18.(共6分)现有下列浓度均为0.1 mol/L的电解质溶液:
① Na2CO3、② NaHCO3、③ 、④ CH3COONH4、⑤ NH4HCO3
、④ CH3COONH4、⑤ NH4HCO3
(1)上述5种物质的溶液既能与盐酸又能与烧碱溶液反应的是(填写序号)。
(2)已知溶液④呈中性,该溶液中离子浓度由大到小的顺序是。
(3)已知溶液⑤呈碱性,比较④、⑤两溶液的酸碱性,可以得出的结论是。