(本题共12分)
水的电离平衡曲线如图所示。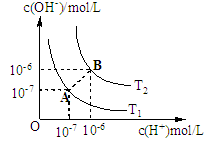
(1)若从A点变动到B点,可以采取的措施是 .
A.加酸溶液 B.加碱溶液 C.加热
(2)现有T1温度下,pH=12的Ba(OH)2溶液。
①该Ba(OH)2溶液的物质的量浓度为 ; ②向该温度下100mLpH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量(假设混合溶液的体积等于混合前两溶液的体积和),此时溶液的pH 7(填“大于”、“小于”或“等于”);原混合溶液中硫酸钠的物质的量浓度为 。
(3)T2温度下,将pH=8的Ba(OH)2溶液与pH=5的稀硫酸混合,使混合后溶液的pH=7,则Ba(OH) 2溶液和稀硫酸的体积比为 。
(4)T1温度下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表;
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
①上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
②相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是: 。
③向NaClO溶液中通入少量二氧化碳,反应的离子方程式为: 。
有0.1mol某有机物和0.25mol氧气在一密闭容器中燃烧,所得气体产物为CO2、CO、H2O(气),产物依次通过浓硫酸时,浓硫酸质量增加了5.4g,再通过炽热的氧化铜时,氧化铜质量减轻了1.6g,最后通过碱石灰时,碱石灰的质量增加了8.8g。
(1)求该有机物的分子式。(请写出计算过程)
(2)写出其可能的结构简式。
(4分)某有机化合物A含碳77.8%,氢7.40%,其余为氧,A的相对分子质量为甲烷的6.75倍。
(1)试计算该有机物的分子式。
(2)红外光谱测定,A分子结构中含有苯环和羟基。在常温下A可与浓溴水反应,1mol A最多可与2 molBr2作用,据此确定该有机物可能的结构简式。
(8分)下列三种有机物都是某些植物挥发油中的主要成分。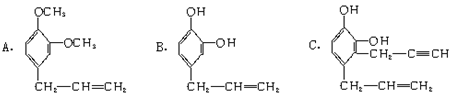
回答下列问题:
(1)这三种有机物均属于(选填字母)_____________。
a.芳香烃 b.酚类 c.芳香族化合物d.不饱和烃类
(2)一定质量的有机物C,在足量O2中完全燃烧,生成CO2和消耗O2的物质的量之比为_____________。
(3)A能发生的反应类型(选填字母)_____________。
a.消去反应 b.与NaOH溶液中和 c.加成反应
d.氧化反应 e.加聚反应 f.还原反应
(4)A分子有多种同分异构体,其中均含有两个“-OCH3”和一个“-CH2-CH=CH2”基团的芳香族化合物除A外还有五种,请写出其余任意两种的结构简式:
____________________________________________________________________。
(1)—CHO的名称是,用电子式可表达为
(2)检验乙醇中是否混有少量水的试剂是,除去乙醇中混有的少量水的试剂和方法是和
(3)由两种烃组成的混合物其平均相对分子质量为18,则混合物中一定含有
(4)任写一种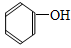 的相邻同系物
的相邻同系物
(5)对原油按沸点不同进行的分离操作称为,把重油转化成轻质油的一系列反应称为
(6)工程塑料ABS树脂合成时用了三种单体。ABS树脂的结构简式为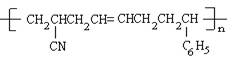 ,式中—C6H5是苯基。这三种单体的结构简式分别
,式中—C6H5是苯基。这三种单体的结构简式分别
是、、。
维生素C主要存在于蔬菜、水果中,它能增加人体对疾病的抵抗能力。其结构简式为: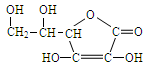
请回答:
(1)维生素C的分子式是,
其分子中官能团的名称是。
(2)维生素C可发生的化学反应有(填序号)。
①加成反应②氧化反应③消去反应
(3)向维生素C的水溶液中滴加紫色石蕊试液,试液变红,说明维生素C的水溶液显性。