根据下列化合物:①H2SO4,②CH3COOH,③NaCl,④NaOH,⑤NH4Cl,⑥NH3•H2O,⑦CH3COONH4,⑧CH3COONa,⑨NH4HSO4, 请回答下列问题:
(1)常温下,pH=10的CH3COONa 溶液中,水电离出来的c(H+)= ;
(2)已知水存在如下平衡: ,现欲使平衡向右移动,
,现欲使平衡向右移动,
且所得溶液显酸性,选择的下列方法是 。
| A.向水中加入NaHSO4固体 | B.向水中加NH4Cl固体 |
| C.加热至100℃ | D.向水中加入NaHCO3固体 |
(3)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液,按pH由大到小的顺序为(填序号) 。
(4)物质的量浓度相同的⑤、⑥、⑦、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号) 。
(5)若浓度均为0.1 mol·L-1、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n(填 “<”、“>”或“=”)。
(6)向NaCl和KBr的混合溶液中加入AgNO3溶液,当两种沉淀共存时,c(Br-)/c(Cl-)=_____________________。
(已知Ksp(AgCl) =2.0×10-10,Ksp(AgBr) =5.4×10-13)
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)⇌2SO3(g)(△H<0)
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值,二氧化硫转化率,化学反应速率(以上均填增大、减小或不变)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是。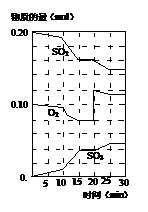
(4)据图判断,反应进行至20min时,曲线发生变化的原因是(用文字表达)。
(5)10min到15min的曲线变化的原因可能是(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度d.增加SO3的物质的量。
(6)能说明该反应已经达到平衡状态的是()
a. v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.恒容容器内物质的密度保持不变
(7)为使该反应的反应速率增大,且平衡向正反应方向移动的是()
a.及时分离出SO3气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
如图为相互串联的甲、乙两电解池。试回答:
(1)若甲电解池利用电解原理在铁上镀铜,则A是、(填电极材料和电极名称),电极反应是;B是(要求同A)、,电极反应是,应选用的电解质溶液是;乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈色。
(2)若甲电解池阴极增重1.28g,乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为mol/L,溶液的pH等于。
(3)若甲电解池以I=0.21A的电流电解60min后阴极增重0.25g,则此实验测得的阿伏加德罗常数NA为多少(已知电子电量e—=1.60×10—19C)?(简要写计算过程)
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
请回答下列问题:
(1)用氨水调节pH至8——9的目的是。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+(填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式:,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因。
有机物A(C12H15ClO3)为含多种官能团的芳香族化合物,其结构简式如图(其中虚线框内为未知部分的结构)所示,A可发生如下转化(其中部分产物已略去)。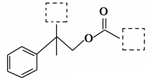
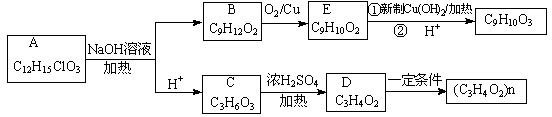
已知:D能使溴的CCl4溶液褪色;B不能与FeCl3溶液发生显色反应,1mol B最多能与2mol金属钠反应;C的催化氧化产物不能发生银镜反应。回答下列问题。
(1)写出C中官能团的名称_。
(2)A的结构简式(写出一种):_。
(3)写出反应类型:C→D;B→E。
(4)写出E与新制Cu(OH)2反应的化学方程式_。
(5)E有多种同分异构体,满足下列条件的同分异构体有种,写出其中任意一种同分异构体的结构简式。
①含有苯环且苯环上只有一个取代基;②分子结构中含有甲基;③能发生水解反应。
A~F六种有机物的相互转化关系如图所示: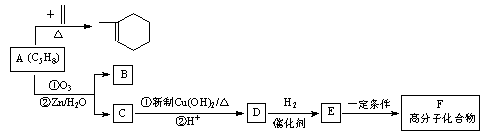
已知 :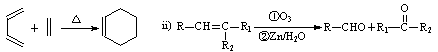
据此回答下列问题:
(1)A是合成天然橡胶的单体,用系统命名法命名,A的名称为,天然橡胶的结构简式为_。
(2)A生成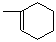 时,A发生的反应类型为。
时,A发生的反应类型为。
(3)E→F的化学方程式为。
(4)A与Br2按物质的量比1∶1发生加成反应,生成的产物有_种(考虑顺反异构)。
(5)现有另一种有机物G,已知G与E无论按何种比例混合,只要总质量一定,完全燃烧时生成的CO2、H2O以及消耗的O2均为定值。请写出两种符合下列要求的G的结构简式_、。
①M(G)<M(E);
②G的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1∶3。