(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
CH3OH(g)+H2O(g)实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是_______(填“吸热”或“放热”)反应;
②从反应开始到第三分钟,氢气的平均反应速率v(H2)= mol·L-1·min-1;
③平衡时CH3OH的体积分数为 。
(2)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1.2molCH3OH(g)和2.4molH2O(g),向B容器中充入1.5molCH3OH(g) 和3.0molH2O(g),两容器分别发生上述(1)中反应的逆反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.4aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L。(连通管中气体体积忽略不计,且不考虑温度的影响)
(3)一定条件下的密闭容器中,反应3H2(g) + 3CO(g)  CH3OCH3(g) + CO2(g) ΔH<0 达到平衡时,要提高CO的转化率,可以采取的措施是 (填字母代号)
CH3OCH3(g) + CO2(g) ΔH<0 达到平衡时,要提高CO的转化率,可以采取的措施是 (填字母代号)
A.升温
B.加压
C.增加CO的浓度
D.分离出二甲醚(CH3OCH3)
E.加入催化剂
(4)已知反应2CH3OH(g) CH3OCH3(g)+ H2O(g)在某温度下的平衡常数K=100。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下。下列说法正确的是____________________
CH3OCH3(g)+ H2O(g)在某温度下的平衡常数K=100。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下。下列说法正确的是____________________
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c/mol L -1 |
0.9 |
0.60 |
0.60 |
A.CH3OH的起始浓度为2.1 mol/L B.平衡时CH3OH的浓度为0.9 mol/L
C.此时正反应速率大于逆反应速率 D.平衡时CH3OH的转化率小于80%
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。
Ⅰ.染料工业排放的废水中含有大量有毒的NO2¯,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为 。
Ⅱ.某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
| 开始沉淀时的pH |
1.9 |
7.0 |
—— |
—— |
4.7 |
—— |
| 沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 。
(2)加入H2O2的作用是 。
(3)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是
(选填:Fe3+、Al3+、Ca2+、Mg2+)。
Ⅲ.印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤① ② ③过滤。(提供的药品:Cl2浓H2SO4 NaOH溶液 CuO Cu)
(16分)氨气是一种重要的基础化工原料,用途广泛。
(1)在微电子工业中,氨水可作刻蚀剂H2O2的清除剂,产物不污染环境。该反应的化学方程式为2NH3+ 3H2O2= +6H2O
(2)工业中常用以下反应合成氨:N2+3H2 2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。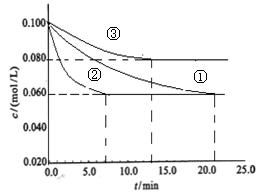
该反应平衡常数的数学表达式为;实验②平衡时H2的转化率为_____。
(3)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______理由:________
③条件:_______理由:________
已知: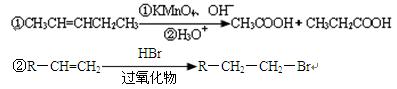
(1)下面是一有机合成反应的流程图: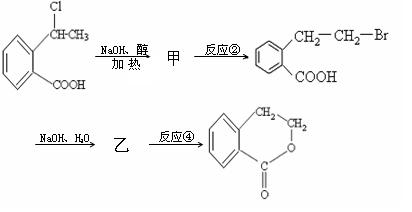
请写出甲与乙的结构简式,甲:乙:
反应②、④的反应类型:、
(2)香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。
写出化合物C的结构简式______;芳香内酯A的核磁共振氢谱共有个吸收峰;D的同分异构体中,是苯的对二取代物,且水解后的一种产物能发生银镜反应,请写出其中一种的结构简式:。
(1)在反应MnO2 + 4HCl = MnCl2 + 2H2O +Cl2↑中,
①还原剂是;
②HCl中,被氧化的Cl原子与未被氧化的Cl原子个数比是 。
③若要产生112 mL氯气,则转移的电子数目是。
(2)、(3分)将2.3g钠投入水中,充分反应后,得到的溶液中Na+与水分子的个数比为1:100,则反应所需的m(H2O)="________"
铝是生活中非常常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,可在生活中应用很广泛,原因是。
(2)铝盐或铁盐能用于净水,是因为铝盐或铁盐在水溶液中形成了。
(3)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示)。
(4)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为。