回答下列问题。
(1)常温时,FeCl3溶液的pH 7(填“>”、“<”或“=”),实验室配制FeCl3溶液时常将FeCl3固体先溶于较浓的盐酸溶液中,然后再用蒸馏水稀释到所需的浓度,原因是 ;将FeCl3溶液蒸干、灼烧,此过程中所涉及到的化学方程式是 。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是 。
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,该溶质的名称是 ,该溶液中四种离子的浓度由大到小的顺序为 。
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为 。
③若溶液中c(Na+)=c(CH3COO-),则该溶液显 (填“酸性”、“碱性”、“中性”),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH) c(CH3COOH)(填“>”、“<”或“=”)。
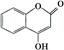 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: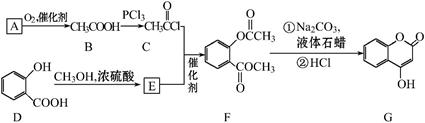
请回答:
(1)B→C的反应类型是______ ______。D中所含的官能团名称是。
(2)下列关于化合物G的说法不正确的是__ ___。
a.分子式是C9H6O3
b.不能与金属钠反应
c.分子中含有4种官能团
d.能与液溴反应
e.1 mol G最多能和4mol氢气反应
(3)写出A与银氨溶液反应的化学方程式。
(4)写出D→E的化学方程式__________________ ___________________。
(8分)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_______ __ ___。
(2)若溶液M由10 mL 2 mol·L-1 NaHA溶液与2 mol·L-1 NaOH溶液等体积混合而得,
则溶液M的pH___7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为_ _ __。
(3)若溶液M有下列三种情况:
①0.01 mol·L-1的H2A溶液
②0.01 mol·L-1的NaHA溶液
③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,
则三种情况的溶液中H2A分子浓度最大的为______;pH由大到小的顺序为______。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为________(填“大于、等于、小于”或“均有可能”)。
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g) H= +180.5kJ·mol-1;
H= +180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) H =" -483.6" kJ·mol-1;
H =" -483.6" kJ·mol-1;
N2(g)+3H2(g)=2NH3(g) H =" -92.4" kJ·mol-1。
H =" -92.4" kJ·mol-1。
则氨的催化氧化反应的热化学方程式为。
(2)汽车尾气净化的一个反应原理为:
2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g) H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。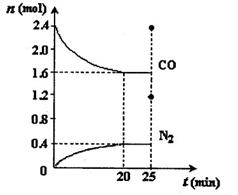
①NO的平衡转化率为,0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将移动(填“向左”、“向右”或“不”)。
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是(填字母代号)。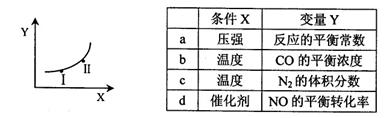
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为。假设电解质溶液的体积不变,下列说法正确的是(填字母代号)。
a.放电过程中,电解质溶液的pH保持不变
b.溶液中的NH4Cl浓度增大,但Cl-离子浓度不变
c.每转移6.02×1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液
(7分)现有部分元素的原子结构特点如下表:
| X |
L层电子数是K层电子数的3倍 |
| Y |
核外电子层数等于原子序数 |
| Z |
L层电子数是K层和M层电子数之和 |
| W |
最外层电子数是次外层电子数的2.5倍 |
(1)画出W原子结构示意图:____________。
(2)元素X与元素Z相比,非金属性较强的是______(填元素符号),写出一个能表示X、Z非金属性强弱关系的化学反应方程式:____________________________。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为________。
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,元素W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式:_______________。
【化学——选修5:有机化学基础】(15分)
有机化合物G是合成维生素类药物的中间体,其结构简式如图所示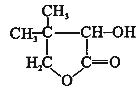
G的合成路线如下图所示: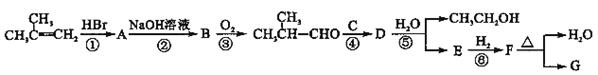
其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去
已知: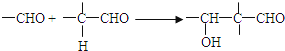
请回答下列问题:
(1)G的分子式是,G中官能团的名称是;
(2)第②步反应的化学方程式是;
(3)B的名称(系统命名)是;
(4)第②~⑥步反应中属于取代反应的有(填步骤编号);
(5)第④步反应的化学方程式是;
(6)写出同时满足下列条件的E的所有同分异构体的结构简式。
①只含一种官能团;②链状结构且无-O-O-;③核磁共振氢谱只有2种峰。