只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是
| |
① |
② |
③ |
④ |
⑤ |
| 甲 |
物质粒子数 |
标准状况下气体摩尔体积 |
固体体积 |
溶质的质量分数 |
非标准状况下物质的质量 |
| 乙 |
阿伏加德罗常数 |
标准状况下气体体积 |
固体密度 |
溶液的体积 |
物质的摩尔质量 |
A.②③④ B.③④⑤ C.③④ D.③
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2=HCN+NaNO2,
②NaCN+HF=HCN+NaF,
③NaNO2+HF=HNO2+NaF。
由此可判断下列叙述中,不正确的是( )
| A.HF的电离平衡常数为7.2×10-4 |
| B.HNO2的电离平衡常数为4.9×10-10 |
| C.根据①③两个反应即可知三种酸的相对强弱 |
| D.HNO2的电离平衡常数比HCN大,比HF小 |
0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大;②c(NH3·H2O)增大;③NH4+数目增多;④c(OH-)增大;⑤导电性增强;⑥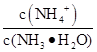 增大
增大
| A.①②③ | B.①③⑤ | C.①③⑥ | D.②④⑥ |
将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是( )
| A.c(H+) | B.Ka(HF) | C.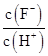 |
D.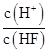 |
相同体积,相同PH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )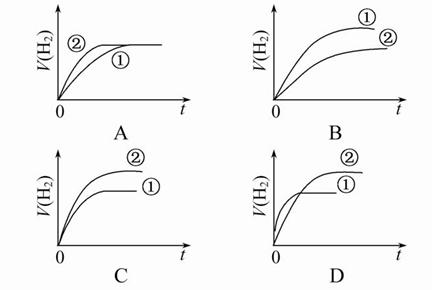
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中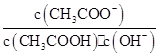 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |